填空题 适中0.65 引用1 组卷165
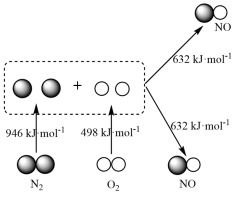
(1)汽车发动机工作时会引发
| 反应 | |||
| 反应热 |
(2)
①实验分别测得
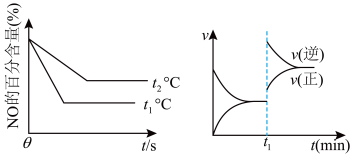
②一定条件下该可逆反应达到平衡后,
(3)利用电化学联合处理法可实现

①阳极的电极反应式为
②若工作前后阴极室成分不变,被处理的
21-22高二上·江苏镇江·期末
知识点:与物质百分含量变化有关图像的分析化学反应速率与化学平衡的综合应用电解池电极反应式及化学方程式的书写与判断利用电子守恒法进行多池串联相关计算 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐  与
与 是大气主要污染物,需要经过净化处理后才能排放。
是大气主要污染物,需要经过净化处理后才能排放。
(1)汽车发动机工作时会引发 和
和 反应生成
反应生成 ,其反应过程中的能量变化如下:
,其反应过程中的能量变化如下:
则
_______ 0,
_______ 0(填“>”或“<”)。
(2) 催化还原氮氧化物是目前应用广泛的烟气氮氧化物脱除技术,如用
催化还原氮氧化物是目前应用广泛的烟气氮氧化物脱除技术,如用 还原
还原 的反应为:
的反应为:
 。
。
①在恒容密闭容器中投入 和
和 发生上述反应,当反应达到化学平衡状态时,测得容器中有
发生上述反应,当反应达到化学平衡状态时,测得容器中有 ,则该反应起始的压强与平衡时的压强之比为
,则该反应起始的压强与平衡时的压强之比为_______ 。
②一定条件下该可逆反应达到平衡后,t1时刻改变某个外界条件,正反应速率v(正)和逆反应的速率v(逆)变化情况如下图所示,则t1时刻改变的外界条件是_______ 。
(3)利用甲烷催化还原氮氧化物。已知:



 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为_______ 。
(4)利用电化学联合处理法可实现 和
和 同时除去,工作原理如下图所示:
同时除去,工作原理如下图所示:
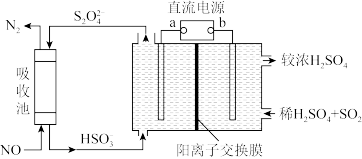
①b是直流电源的_______ 极。
②若电解池阴极室中溶液 在
在 之间,阴极的电极反应式为
之间,阴极的电极反应式为_______ 。
③吸收池中发生的离子方程式为_______ 。
(1)汽车发动机工作时会引发
| 反应 | |||
| 焓变、熵变 |
(2)
①在恒容密闭容器中投入
②一定条件下该可逆反应达到平衡后,t1时刻改变某个外界条件,正反应速率v(正)和逆反应的速率v(逆)变化情况如下图所示,则t1时刻改变的外界条件是

(3)利用甲烷催化还原氮氧化物。已知:
(4)利用电化学联合处理法可实现

①b是直流电源的
②若电解池阴极室中溶液
③吸收池中发生的离子方程式为
合成氨是人类科学技术上的一项重大突破。工业上以天然气为原料合成氨。其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.1kJ/mol
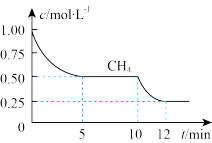
①在一密闭容器中进行上述反应,测得CH4的物质的量浓度随反应时间的变化如下图所示。处于平衡的时间段为_______ 、_______ ;前5min内,用H2表示的速率为_______ ;10min时,改变的外界条件可能是_______ 。
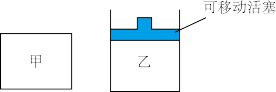
②如图所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡所需要时间:t甲_______ t乙(填“>”“<”或“=”,下同),达到平衡时两容器中CH4的转化率大小关系为:α甲(CH4)_______ α乙(CH4);
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g),一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是_______ (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)工业合成氨的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g),ΔH=-92.4kJ·mol-1.在某压强恒定的密闭容器中加入2molN2和4molH2,达到平衡时,N2的转化率为50%,体积变为10L。求:
①该条件下的平衡常数为_______ ;
②若向该容器中加入amolN2、bmolH2、cmolNH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量_______ (填“>”“<”或“=”)92.4kJ。
(1)造气阶段的反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.1kJ/mol
①在一密闭容器中进行上述反应,测得CH4的物质的量浓度随反应时间的变化如下图所示。处于平衡的时间段为

②如图所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡所需要时间:t甲

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g),一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)工业合成氨的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g),ΔH=-92.4kJ·mol-1.在某压强恒定的密闭容器中加入2molN2和4molH2,达到平衡时,N2的转化率为50%,体积变为10L。求:
①该条件下的平衡常数为
②若向该容器中加入amolN2、bmolH2、cmolNH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网