解答题-工业流程题 适中0.65 引用1 组卷49
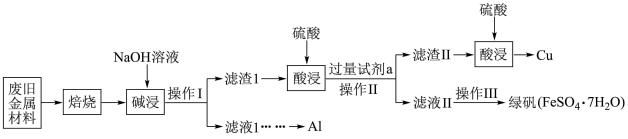
某废旧金属材料中主要含Fe、Cu、Al、FeO、Al2O3、CuO (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
回答下列问题:
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去_______ 。
(2)操作I、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是_______ 。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取被部分氧化为硫酸铁的晶体8.22 g溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32 g;再通入112 mL (标准状况)氯气恰好将其中的Fe2+完全氧化。
①为确定绿矾未被全部氧化,可选择的最佳试剂是_______ (填标号)。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.KMnO4酸性溶液
②推测晶体的化学式为_______ (写成 的形式)。
的形式)。

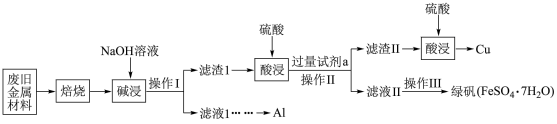
回答下列问题:
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去
(2)操作I、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取被部分氧化为硫酸铁的晶体8.22 g溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32 g;再通入112 mL (标准状况)氯气恰好将其中的Fe2+完全氧化。
①为确定绿矾未被全部氧化,可选择的最佳试剂是
A.氯水 B.KSCN溶液 C.NaOH溶液 D.KMnO4酸性溶液
②推测晶体的化学式为
21-22高一下·河南商丘·开学考试
类题推荐
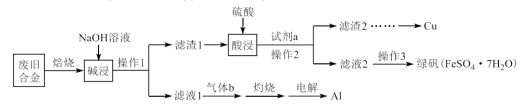
铁是应用广泛的金属,铁的卤化物、及高价铁的含氧酸盐均为重要的化合物。某废旧金属材料主要含Fe、Cu、Al、FeO、 、CuO(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
、CuO(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
回答下列问题:
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去___________ 。
(2)写出“碱浸”过程中NaOH溶液参与反应的离子方程式:___________ 。
绿矾在空气中可逐渐风化而失去一部分水,并且表面容易氧化为黄褐色碱式硫酸铁 :
: 。为测定某部分被氧化的绿矾中亚铁离子的质量分数设计如下实验,取该晶体8.22 g溶于水后,加入20.00 mL 0.10 mol/L酸性高锰酸钾溶液,恰好将其中的
。为测定某部分被氧化的绿矾中亚铁离子的质量分数设计如下实验,取该晶体8.22 g溶于水后,加入20.00 mL 0.10 mol/L酸性高锰酸钾溶液,恰好将其中的 完全氧化(
完全氧化( 离子被还原为
离子被还原为 )。
)。
回答下列问题:
(3)实验前,要配制0.10 mol/L的 溶液240毫升,配制时需要的仪器除电子天平外,还需要的仪器有烧杯、玻璃棒、
溶液240毫升,配制时需要的仪器除电子天平外,还需要的仪器有烧杯、玻璃棒、___________ 。
(4)上述实验中的 溶液要进行酸化,可用于酸化的酸是___________(选填编号)。
溶液要进行酸化,可用于酸化的酸是___________(选填编号)。
(5)酸性高锰酸钾溶液氧化 的离子方程式为:
的离子方程式为:___________ 。
(6)被氧化的绿矾中亚铁离子的质量分数为:___________ 。
可将 和空气的混合气体通入
和空气的混合气体通入 、
、 、
、 的混合溶液中反应回收S,其物质转化如图所示。
的混合溶液中反应回收S,其物质转化如图所示。
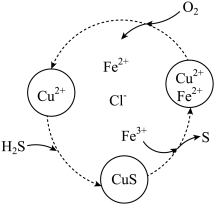
回答下列问题:
(7)在图示的转化中: 转化为
转化为 的离子方程式是
的离子方程式是___________ ;当有1 mol  转化为硫单质时,若保持溶液中
转化为硫单质时,若保持溶液中 的物质的量不变,需要消耗
的物质的量不变,需要消耗 的物质的量为
的物质的量为___________ 。

回答下列问题:
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去
(2)写出“碱浸”过程中NaOH溶液参与反应的离子方程式:
绿矾在空气中可逐渐风化而失去一部分水,并且表面容易氧化为黄褐色碱式硫酸铁
回答下列问题:
(3)实验前,要配制0.10 mol/L的
(4)上述实验中的
| A.稀硝酸 | B.稀硫酸 | C.稀盐酸 | D.以上三种酸都可以 |
(6)被氧化的绿矾中亚铁离子的质量分数为:
可将

回答下列问题:
(7)在图示的转化中:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网