解答题-原理综合题 适中0.65 引用1 组卷404
绿色能源的开发利用是未来能源发展的重要方向,也是实现“碳中和”目标的重要举措。氢能是重要的绿色能源,利用甲烷来制取氢气的总反应可表示为: ,该反应可通过如下过程来实现:
,该反应可通过如下过程来实现:
反应Ⅰ:
反应Ⅱ:
(1)总反应的
___________ 
(2)反应Ⅰ在恒压条件下,不同进气比 和不同温度时测得相应的
和不同温度时测得相应的 平衡转化率见下表。
平衡转化率见下表。
①c点平衡混合物中 的体积分数为
的体积分数为___________ ,a、b两点对应的反应速率
___________  (填“<”、“=”或“>”),判断的理由为
(填“<”、“=”或“>”),判断的理由为___________ 。
②若d点的总压强为 ,则d点的分压平衡常数
,则d点的分压平衡常数 为
为___________ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(3)反应Ⅱ在工业上称为一氧化碳的催化变换反应,研究表明该反应用 作催化剂,反应历程如下:
作催化剂,反应历程如下:
第一步:
第二步:
已知第一步为慢反应,则第一步反应的活化能比第二步反应___________ (填“大”或“小”)。
由于 还原性较强,若将
还原性较强,若将 还原成
还原成 ,并以
,并以 的形式大量存在于反应体系中,会使催化剂失去活性,但在实际生产中一般不会发生催化剂失去活性的情况,请结合一氧化碳的催化变换反应历程说明理由
的形式大量存在于反应体系中,会使催化剂失去活性,但在实际生产中一般不会发生催化剂失去活性的情况,请结合一氧化碳的催化变换反应历程说明理由___________ 。
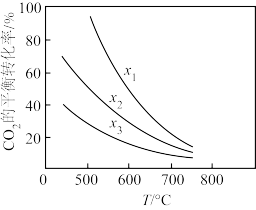
(4)用二氧化碳与氢气催化加氢制乙醇,其反应原理为:
 。经实验测定在不同投料比
。经实验测定在不同投料比 时
时 的平衡转化率与温度的关系如图曲线所示
的平衡转化率与温度的关系如图曲线所示 :从平衡角度分析,随温度升高,不同投料比时
:从平衡角度分析,随温度升高,不同投料比时 的平衡转化率趋于相近的原因是
的平衡转化率趋于相近的原因是___________ 。
反应Ⅰ:
反应Ⅱ:
(1)总反应的
(2)反应Ⅰ在恒压条件下,不同进气比
| 平衡点 | a | b | c | d |
| 0.5 | 0.5 | 1 | 1 | |
| 50 | 69 | 50 | 20 |
①c点平衡混合物中
②若d点的总压强为
(3)反应Ⅱ在工业上称为一氧化碳的催化变换反应,研究表明该反应用
第一步:
第二步:
已知第一步为慢反应,则第一步反应的活化能比第二步反应
由于
(4)用二氧化碳与氢气催化加氢制乙醇,其反应原理为:

2022·湖北襄阳·模拟预测
类题推荐
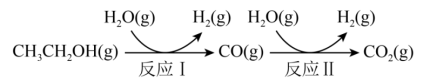
绿色能源是未来能源发展的重要方向,氢能是重要的绿色能源,利用生物乙醇来制取氢气的部分反应过程如图所示。

(1)已知:反应①:CH3CH2OH(g)+3H2O(g)=2CO2(g)+6H2(g) ΔH1=+173.5kJ·mol-1
反应②:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1
则反应Ⅰ的热化学方程式为____ 。
(2)反应Ⅱ在不同进气比[n(CO)∶n(H2O)]、不同温度下,测得相应的CO平衡转化率见表(各点对应的其他反应条件都相同)。
①a点平衡混合物中H2的体积分数为____ ,a、c两点对应的反应温度Ta____ Tc(填“<”“=”或“>”),d点对应的平衡常数K=____ 。
②有利于提高CO平衡转化率的是____ (填标号)。
A.增大压强 B.降低温度 C.增大进气比[n(CO)∶n(H2O)] D.分离出CO2
(3)反应Ⅱ在工业上称为一氧化碳的催化变换反应,若用[K]表示催化剂,则反应历程可用下式表示:
第一步:[K]+H2O(g)=[K]O+H2
第二步:[K]O+CO=[K]+CO2
第二步比第一步反应慢,则第二步反应的活化能比第一步反应____ 。
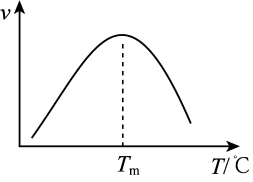
(4)研究表明,CO催化变换反应的速率方程为 =k(
=k( -
- )式中,yCO、
)式中,yCO、 、
、 、
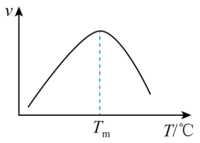
、 分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp___ (填“增大”“减小”)。根据速率方程分析,T>Tm时 逐渐减小的原因是
逐渐减小的原因是____ 。

(1)已知:反应①:CH3CH2OH(g)+3H2O(g)=2CO2(g)+6H2(g) ΔH1=+173.5kJ·mol-1
反应②:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1
则反应Ⅰ的热化学方程式为
(2)反应Ⅱ在不同进气比[n(CO)∶n(H2O)]、不同温度下,测得相应的CO平衡转化率见表(各点对应的其他反应条件都相同)。
| 平衡点 | a | b | c | d |
| n(CO)∶n(H2O) | 0.5 | 0.5 | 1 | 1 |
| CO平衡转化率/% | 50 | 66.7 | 50 | 60 |
②有利于提高CO平衡转化率的是
A.增大压强 B.降低温度 C.增大进气比[n(CO)∶n(H2O)] D.分离出CO2
(3)反应Ⅱ在工业上称为一氧化碳的催化变换反应,若用[K]表示催化剂,则反应历程可用下式表示:
第一步:[K]+H2O(g)=[K]O+H2
第二步:[K]O+CO=[K]+CO2
第二步比第一步反应慢,则第二步反应的活化能比第一步反应
(4)研究表明,CO催化变换反应的速率方程为

绿色能源是未来能源发展的重要方向,氢能是重要的绿色能源,利用生物乙醇来制取氢气的部分反应过程如下图所示。

(1)已知:CH3CH2OH(g)+3H2O(g)=2CO2(g)+6H2(g) ΔH1=+173.5kJ·mol-1
反应Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1
则反应Ⅰ的热化学方程式为___________ 。
(2)反应Ⅱ在不同进气比[n(CO)∶n(H2O)]、不同温度下,测得相应的CO平衡转化率见下表(各点对应的其他反应条件都相同)。
①a点平衡混合物中H2的体积分数为___________ ,a、c两点对应的反应温度Ta___________ Tc(填“<”“=”或“>”),d点对应的平衡常数K=___________ 。
②有利于提高CO平衡转化率的是___________ (填标号)。
A.增大压强 B.降低温度 C.增大进气比[n(CO)∶n(H2O)] D.分离出CO2
(3)反应Ⅱ在工业上称为一氧化碳的催化变换反应,若用[K]表示催化剂,则反应历程可用下式表示:
第一步:[K]+H2O(g)=[K]O+H2
第二步:[K]O+CO=[K]+CO2
第二步比第一步反应慢,则第二步反应的活化能比第一步反应___________ 。反应过程中,相对能量最高的中间产物是催化剂吸附态的___________ (填标号)。
A.水蒸气 B.氧原子 C.一氧化碳 D.二氧化碳
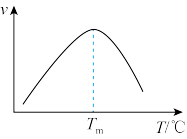
(4)研究表明,CO催化变换反应的速率方程为v=k( )式中,
)式中, 分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
分别表示相应的物质的量分数,Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp___________ (填“增大”“减小”)。根据速率方程分析,T>Tm时v逐渐减小的原因是___________ 。

(1)已知:CH3CH2OH(g)+3H2O(g)=2CO2(g)+6H2(g) ΔH1=+173.5kJ·mol-1
反应Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1
则反应Ⅰ的热化学方程式为
(2)反应Ⅱ在不同进气比[n(CO)∶n(H2O)]、不同温度下,测得相应的CO平衡转化率见下表(各点对应的其他反应条件都相同)。
| 平衡点 | a | b | c | d |
| n(CO)∶n(H2O) | 0.5 | 0.5 | 1 | 1 |
| CO平衡转化率/% | 50 | 66.7 | 50 | 60 |
②有利于提高CO平衡转化率的是
A.增大压强 B.降低温度 C.增大进气比[n(CO)∶n(H2O)] D.分离出CO2
(3)反应Ⅱ在工业上称为一氧化碳的催化变换反应,若用[K]表示催化剂,则反应历程可用下式表示:
第一步:[K]+H2O(g)=[K]O+H2
第二步:[K]O+CO=[K]+CO2
第二步比第一步反应慢,则第二步反应的活化能比第一步反应
A.水蒸气 B.氧原子 C.一氧化碳 D.二氧化碳
(4)研究表明,CO催化变换反应的速率方程为v=k(

化石能源对环境污染严重,且不可再生。氢能是重要的绿色能源,越来越受到各国的重视,中国科学院利用生物乙醇来制取氢气的部分反应过程如下图所示。

反应Ⅱ:

则反应I的热化学方程式为______ 。
(2)反应Ⅱ在不同进气比[n(CO):n(H2O)]、不同温度下,测得相应的CO平衡转化率见下表(各点对应的其他反应条件都相同)。
①c点平衡混合物中H2的体积分数为______ ,a、c两点对应的反应温度Ta______ Tc(填“<”“=”或“>”),c点对应的平衡常数K=______ 。
②有利于提高CO平衡转化率的是______ (填标号)。
A.增大压强 B.降低温度 C.增大进气比[n(CO):n(H2O)] D.加入高效催化剂
(3)反应Ⅱ在工业上称为一氧化碳的催化变换反应,若用 表示催化剂,则反应历程可用下式表示:
表示催化剂,则反应历程可用下式表示:
第一步: ;第二步:
;第二步:
第二步比第一步反应慢,则第二步反应的活化能比第一步反应______ 。反应整个反应过程中,那个物质的浓度对总反应速率影响最大______ (填标号)。
A.水蒸气 B.氢气 C.一氧化碳 D.二氧化碳
(4)研究所表明,CO催化变换反应的速率方程为
 式中,
式中, ,分别表示相应的物质的量分数,
,分别表示相应的物质的量分数, 为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,
为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时, 催化变换反应的
催化变换反应的
______ (填“增大”或“减小”)。根据速率方程分析, 时
时 逐渐减小的原因是
逐渐减小的原因是______ 。
反应Ⅱ:
则反应I的热化学方程式为
(2)反应Ⅱ在不同进气比[n(CO):n(H2O)]、不同温度下,测得相应的CO平衡转化率见下表(各点对应的其他反应条件都相同)。
| 平衡点 | a | b | c | d |
| n(CO):n(H2O) | 2 | 2 | 1 | 1 |
| CO平衡转化率/ | 25 | 68 | 25 | 60 |
①c点平衡混合物中H2的体积分数为
②有利于提高CO平衡转化率的是
A.增大压强 B.降低温度 C.增大进气比[n(CO):n(H2O)] D.加入高效催化剂
(3)反应Ⅱ在工业上称为一氧化碳的催化变换反应,若用
第一步:
第二步比第一步反应慢,则第二步反应的活化能比第一步反应
A.水蒸气 B.氢气 C.一氧化碳 D.二氧化碳
(4)研究所表明,CO催化变换反应的速率方程为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


