解答题-实验探究题 较难0.4 引用4 组卷836
四水醋酸锰[ ]用于染色催化剂和分析试剂等。
]用于染色催化剂和分析试剂等。
(1)以四水醋酸锰为电解液,控制适当电压电解,降低温度后减压抽滤,用乙酸洗涤干燥,制得 。将
。将 在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
在氮气气氛中加热,以热重分析仪测量分解时温度变化和失重。
①第一阶段释放出2种等物质的量的物质,它们的分子式分别为_______ 。
②剩余物B的化学式为_______ 。
(2)用四水醋酸锰和乙酰氯( )为原料制备无水二氯化锰流程如下:
)为原料制备无水二氯化锰流程如下:
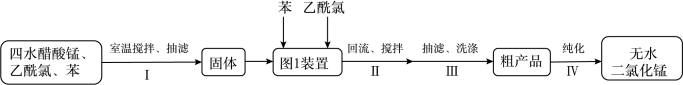
已知:a无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸、不溶于苯。
b.制备无水二氯化锰的主要反应:
c.乙酰氯遇水发生反应: 。
。
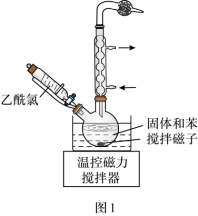
请回答:
①步骤Ⅰ所获固体主要成分是_______ (用化学式表示)。
②步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,加热回流的目的是_______ 。
③测定无水 的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量,将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 ,使
,使 氧化为
氧化为 。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[
。待充分反应后持续加热一段时间,冷却后用bmol/L硫酸亚铁铵[ ]滴定
]滴定 ,滴定过程中发生的反应为:
,滴定过程中发生的反应为: ,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是
,消耗cmL硫酸亚铁按溶液。“持续加热”的目的是_______ 。样品中 的质量分数多少(写出计算过程)。
的质量分数多少(写出计算过程)。_______
(1)以四水醋酸锰为电解液,控制适当电压电解,降低温度后减压抽滤,用乙酸洗涤干燥,制得
| 阶段 | 热效应 | 剩余物 | 失重 |
| Ⅰ | 吸热 | A | 29.1% |
| Ⅱ | 放热 | B | 70.5% |
②剩余物B的化学式为
(2)用四水醋酸锰和乙酰氯(

已知:a无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸、不溶于苯。
b.制备无水二氯化锰的主要反应:
c.乙酰氯遇水发生反应:

请回答:
①步骤Ⅰ所获固体主要成分是
②步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,加热回流的目的是
③测定无水
2022·江苏南京·模拟预测
类题推荐
无水氯化锰 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入 溶液,充分反应后加入
溶液,充分反应后加入 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入 气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______ 。
(2)步骤I中:
①Fe2+浓度降低,滤渣中存在 。结合离子方程式解释原因:
。结合离子方程式解释原因:_______ 。
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、______ 。
(3)步骤II中:
① 酸性溶液的作用:
酸性溶液的作用:_______ 。
②结合离子方程式说明MnCO3的作用:_______ 。
(4)步骤III通入H2S后, Ni2+不达标而 达标。推测溶解度:PbS
达标。推测溶解度:PbS_____ NiS(填“>”或“<”)。
(5)测定无水 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 ,使
,使 氧化为
氧化为 。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵 滴定
滴定 ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
①样品中MnCl2的质量分数是_____ (已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的 分解。若不加热,测定结果会
分解。若不加热,测定结果会______ (填“偏高”、“偏低”或“无影响”)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入
III.向II的滤液中通入
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
| 初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
| 步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
| 步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
| 步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是
(2)步骤I中:
①Fe2+浓度降低,滤渣中存在
②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、
(3)步骤II中:
①
②结合离子方程式说明MnCO3的作用:
(4)步骤III通入H2S后, Ni2+不达标而
(5)测定无水
①样品中MnCl2的质量分数是
②“持续加热”的目的是使过量的
无水氯化锰(MnCI2)在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.酸溶:向粗锰粉中加入盐酸,控制溶液的pH约为5,测定各杂质离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.除铁:向I的滤液中加入一定量盐酸,再加入H2O2溶液,充分反应后加入MnCO3固体调节溶液的pH约为5,过滤;
III.H2S除镍铅:向II的滤液中通入H2S气体,待充分反应后过滤,将溶液煮沸,再加入 H2O2溶液,冷却后过滤出黄色沉淀;
IV.重结晶:将III的滤液浓缩、结晶、过滤、洗涤,经二次结晶、脱水得到合格的无水MnCl2。
各步骤中对杂质离子的去除情况
已知:金属活动性Mn>Fe>Ni>Pb
回答下列问题:
(1)锰和盐酸反应的化学方程式是___________ 。
(2)步骤I中:
①加入过量锰粉的作用除控制溶液pH外,还有___________ 。
②滤渣中还存在少量Fe(OH)3,静置过程中,产生Fe(OH)3的离子方程式是___________ 。
(3)步骤II中:
①加入H2O2溶液,发生反应的离子方程式是___________ 。
②加入MnCO3固体的目的是___________ 。
(4)步骤III中,再次加入H2O2溶液的目的是___________ 。
(5)通过步骤Ⅰ、Ⅱ、Ⅲ后,Pb2+的去除率约为___________ ;步骤Ⅳ中主要去除的杂质是___________ (填写化学式)。
(6)测定无水MnCl2的含量:将a g样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量NH4NO3,使Mn2+氧化为Mn3+。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵【(NH4)2Fe(SO4)2】滴定Mn3+ 滴定过程中发生的反应为:Fe2+ + Mn3+=Fe3+ + Mn2+),消耗c mL硫酸亚铁铵。
① 样品中MnCl2的质量分数是___________ 。
②“持续加热”的目的是使过量的NH4NO3分解。若不加热,测定结果会___________ (填“偏高”、“偏低”或“无影响”)。
I.酸溶:向粗锰粉中加入盐酸,控制溶液的pH约为5,测定各杂质离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.除铁:向I的滤液中加入一定量盐酸,再加入H2O2溶液,充分反应后加入MnCO3固体调节溶液的pH约为5,过滤;
III.H2S除镍铅:向II的滤液中通入H2S气体,待充分反应后过滤,将溶液煮沸,再加入 H2O2溶液,冷却后过滤出黄色沉淀;
IV.重结晶:将III的滤液浓缩、结晶、过滤、洗涤,经二次结晶、脱水得到合格的无水MnCl2。
各步骤中对杂质离子的去除情况
| Fe2+ | Ni2+ | Pb2+ | |
| 初始浓度/mg·L-1 | 21.02 | 4.95 | 5.86 |
| 步骤I后/ mg·L-1 | 12.85 | 3.80 | 3.39 |
| 步骤II后/ mg·L-1 | 0.25 | 3.76 | 3.38. |
| 步骤Ⅲ后/ mg·L-1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
回答下列问题:
(1)锰和盐酸反应的化学方程式是
(2)步骤I中:
①加入过量锰粉的作用除控制溶液pH外,还有
②滤渣中还存在少量Fe(OH)3,静置过程中,产生Fe(OH)3的离子方程式是
(3)步骤II中:
①加入H2O2溶液,发生反应的离子方程式是
②加入MnCO3固体的目的是
(4)步骤III中,再次加入H2O2溶液的目的是
(5)通过步骤Ⅰ、Ⅱ、Ⅲ后,Pb2+的去除率约为
(6)测定无水MnCl2的含量:将a g样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量NH4NO3,使Mn2+氧化为Mn3+。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵【(NH4)2Fe(SO4)2】滴定Mn3+ 滴定过程中发生的反应为:Fe2+ + Mn3+=Fe3+ + Mn2+),消耗c mL硫酸亚铁铵。
① 样品中MnCl2的质量分数是
②“持续加热”的目的是使过量的NH4NO3分解。若不加热,测定结果会
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网