解答题-实验探究题 适中0.65 引用3 组卷657
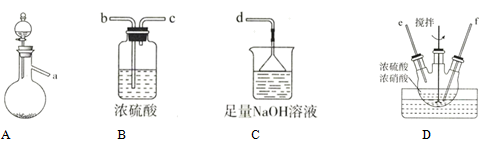
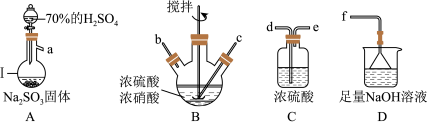
亚硝酰硫酸(NOSO4H)在重氮化反应中可以代替亚硝酸钠。实验室用如图装置(夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
已知:①亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解。
②实验室制备亚硝酰硫酸的原理为SO2+HNO3=SO3+HNO2,SO3+HNO2=NOSO4H。
回答下列问题:
(1)仪器I的名称为_______ ,写出A中反应的化学方程式_______ 。
(2)按照气流从左到右的顺序,上述仪器的连接顺序为_______ (填仪器接口的字母,部分仪器可以重复使用)。
(3)装置B中的“冷水”控制在20℃左右,温度不宜过高或过低的原因是_______ 。
(4)在上述反应条件下,开始时反应缓慢,但某时刻反应速率明显加快,其原因是_______ 。
(5)如果不使用装置C,造成的影响是_______ 。
(6)测定亚硝酰硫酸的纯度
已知:2KMnO4 + 5NOSO4H +2H2O =K2SO4 + 2MnSO4 + 5HNO3 +2H2SO4;2 + 5
+ 5 +16H+ =2Mn2++10CO2↑+8H2O。
+16H+ =2Mn2++10CO2↑+8H2O。
步骤如下:
步骤1:准确称取14. 00g产品,在特定条件下配制成250 mL溶液。
步骤2:取25. 00 mL产品于250 mL容量瓶中,加入60. 00 mL未知浓度KMnO4溶液(过量)和10. 00 mL 25%H2SO4溶液,然后摇匀。
步骤3:用0. 2500 mol· L-1 Na2C2O4标准溶液滴定,消耗Na2C2O4溶液20. 00 mL。
把亚硝酰硫酸溶液换为蒸馏水(空白实验) ,复上述步骤,消耗Na2C2O4溶液的体积为60. 00 mL。
①达到滴定终点时的现象为_______ 。
②亚硝酰硫酸的纯度为_______ (精确到0.1%)。

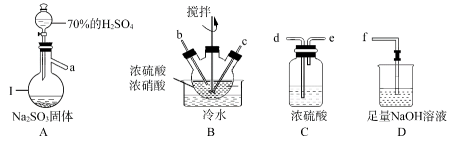
已知:①亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解。
②实验室制备亚硝酰硫酸的原理为SO2+HNO3=SO3+HNO2,SO3+HNO2=NOSO4H。
回答下列问题:
(1)仪器I的名称为
(2)按照气流从左到右的顺序,上述仪器的连接顺序为
(3)装置B中的“冷水”控制在20℃左右,温度不宜过高或过低的原因是
(4)在上述反应条件下,开始时反应缓慢,但某时刻反应速率明显加快,其原因是
(5)如果不使用装置C,造成的影响是
(6)测定亚硝酰硫酸的纯度
已知:2KMnO4 + 5NOSO4H +2H2O =K2SO4 + 2MnSO4 + 5HNO3 +2H2SO4;2
步骤如下:
步骤1:准确称取14. 00g产品,在特定条件下配制成250 mL溶液。
步骤2:取25. 00 mL产品于250 mL容量瓶中,加入60. 00 mL未知浓度KMnO4溶液(过量)和10. 00 mL 25%H2SO4溶液,然后摇匀。
步骤3:用0. 2500 mol· L-1 Na2C2O4标准溶液滴定,消耗Na2C2O4溶液20. 00 mL。
把亚硝酰硫酸溶液换为蒸馏水(空白实验) ,复上述步骤,消耗Na2C2O4溶液的体积为60. 00 mL。
①达到滴定终点时的现象为
②亚硝酰硫酸的纯度为
2022·广西·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网