解答题-实验探究题 0.65 引用1 组卷300
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂。它易溶于水,难溶于酒精,受热、遇酸易分解。工业上以硫化钠、碳酸钠和二氧化硫为原料制备,实验室模拟该工业过程的装置如图所示(省略夹持装置)。回答下列问题:
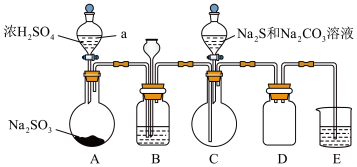
(1)仪器a的名称是________ 。
(2)装置A中发生反应的化学方程式是________ 。
(3)装置B中盛装饱和NaHSO3溶液,其作用之一.是观察SO2的生成速率,实验中为了使SO2缓慢进入C烧瓶,充分反应,正确的操作是_______ 。
(4)在装置C中生成Na2S2O3。
①配平反应方程式:______ ,_____SO2+_____ Na2S +_____ Na2CO3=_____Na2S2O3 +_____CO2。
②控制C中的溶液的pH接近7,停止通入SO2。若未控制好,溶液酸性较强,会影响Na2S2O3的产率,原因是_____ (用离子方程式表示)。
(5)将C所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为______ 。
(6)装置D的作用是_______ 。
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250 mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度。在锥形瓶中加入25 mL 0.01 mol·L-1 KIO3溶液,并加入过量的KI酸化,发生如下反应:5I-+ +6H+=3I2+3H2O;再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生如下反应:I2+ 2
+6H+=3I2+3H2O;再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生如下反应:I2+ 2 =2I- +
=2I- +  ,当蓝色褪去且半分钟不变色时达到滴定终点。实验数据如下表:
,当蓝色褪去且半分钟不变色时达到滴定终点。实验数据如下表:
则该产品的纯度是_______ (用百分数表示,保留1位小数),间接碘量法滴定过程中可能造成实验结果偏低的是_______ 。
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡

(1)仪器a的名称是
(2)装置A中发生反应的化学方程式是
(3)装置B中盛装饱和NaHSO3溶液,其作用之一.是观察SO2的生成速率,实验中为了使SO2缓慢进入C烧瓶,充分反应,正确的操作是
(4)在装置C中生成Na2S2O3。
①配平反应方程式:
②控制C中的溶液的pH接近7,停止通入SO2。若未控制好,溶液酸性较强,会影响Na2S2O3的产率,原因是
(5)将C所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为
(6)装置D的作用是
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250 mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度。在锥形瓶中加入25 mL 0.01 mol·L-1 KIO3溶液,并加入过量的KI酸化,发生如下反应:5I-+
| 实验序号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液体积(mL) | 16.98 | 15.82 | 15.80 | 15.78 |
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
21-22高三上·四川成都·开学考试


