解答题-实验探究题 适中0.65 引用1 组卷56
某研究性学习小组制取氨气,并利用氨气和氧化铜反应来验证氨气分子中氮、氢原子的个数比,按如图所示装置进行实验。已知:氨气与灼热的氧化铜反应,生成铜、水和氮气。
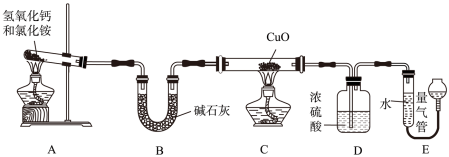
(1)装置A 中发生反应的化学方程式为_______ 。
(2)实验中,先断开C与D,加热装置_______ (填“A”或“C”)片刻,再连接C与D,加热另一个装置,其目的是_______ 。
(3)装置C 的玻璃管中发生反应的化学方程式为_______ ,若固体的质量减少3.2g,则该反应中转移电子的物质的量为_______ 。
(4)称量反应前后,玻璃管(含固体物质)的质量分别为m1g、m2g;生成的氮气在标准状况下的体积为VL。用所测数据计算出氨气分子中氮、氢原子个数之比为_______ 。
(5)小组同学还测定了反应前后装置D(含药品)的质量和生成的氮气体积(在标准状况下)。由此数据计算出的氨气分子中氮、氢原子个数比小于理论值,其原因是_______ 。

(1)装置A 中发生反应的化学方程式为
(2)实验中,先断开C与D,加热装置
(3)装置C 的玻璃管中发生反应的化学方程式为
(4)称量反应前后,玻璃管(含固体物质)的质量分别为m1g、m2g;生成的氮气在标准状况下的体积为VL。用所测数据计算出氨气分子中氮、氢原子个数之比为
(5)小组同学还测定了反应前后装置D(含药品)的质量和生成的氮气体积(在标准状况下)。由此数据计算出的氨气分子中氮、氢原子个数比小于理论值,其原因是
21-22高一下·辽宁朝阳·阶段练习
类题推荐
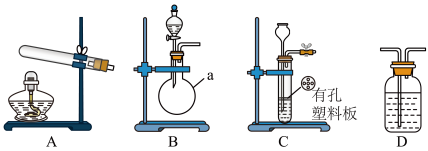
甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称_______ 。
(2)检查A装置气密性的操作是_______ 。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为_______ 。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是_______ 。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是_______ 。

实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称
(2)检查A装置气密性的操作是
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸、硫酸铵 | 反应的化学方程式为 |
| 乙小组 | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: |
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是
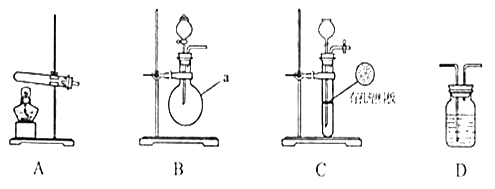
甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量为m1 g、氧化铜反应后剩余固体的质量为m2 g生成氮气在标准状况下的体积V1 L。
乙小组测得:洗气前装置D的质量m3 g、洗气后装置后D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:__________________________________ 。
(2)检查A装置气密性的操作时___________________________________________ 。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为____________________ 。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是_______________________________ 。为此,乙小组在原有实验的基础上增加了一个装装有药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果.该药品的名称是____________________________ 。

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。

甲小组测得:反应前氧化铜的质量为m1 g、氧化铜反应后剩余固体的质量为m2 g生成氮气在标准状况下的体积V1 L。
乙小组测得:洗气前装置D的质量m3 g、洗气后装置后D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:
(2)检查A装置气密性的操作时
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 |
| 乙小组 | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: |
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是
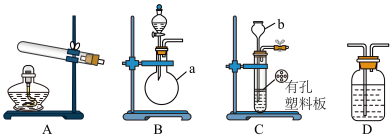
为测定氨分子中氮、氢原子个数比。某研究性学习小组设计了如下实验流程:

实验时,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的单质铜。
如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
实验1测得反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成的氮气在标准状况下的体积V1L。
实验2测得洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成的氮气在标准状况下的体积V2L。请回答下列问题:
(1)写出仪器a和b的名称分别是:圆底烧瓶和______________ 。
(2)检查A装置气密性的操作是_____________________________ 。
(3)实验1和实验2分别选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填或相关化学方程式写在下表的空格中。
(4)实验1用所测数据计算出氨分子中氮、氢的原子个数比为______________ 。(列式子,不计算结果)
(5)实验2用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是_____________________ 。为此,实验2在原有实验的基础上增加了一个装有某药品的实验仪器重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果。该药品和实验仪器的名称分别是__________ 和____________ 。

实验时,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的单质铜。
如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

实验1测得反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成的氮气在标准状况下的体积V1L。
实验2测得洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成的氮气在标准状况下的体积V2L。请回答下列问题:
(1)写出仪器a和b的名称分别是:圆底烧瓶和
(2)检查A装置气密性的操作是
(3)实验1和实验2分别选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填或相关化学方程式写在下表的空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 实验1 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为:① |
| 实验2 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用:③ |
(5)实验2用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


