填空题 适中0.65 引用1 组卷159
氮是一种典型的非金属元素,其单质及化合物在生活和生产中具有广泛的用途。请回答下列问题:
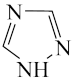
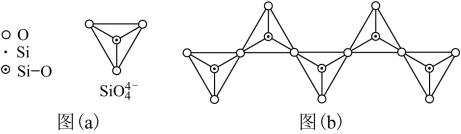
(1)科学家目前合成了 分子,其结构如图所示。
分子,其结构如图所示。 分子中氮原子的杂化轨道类型是
分子中氮原子的杂化轨道类型是_______ , 键角为
键角为_______ ; 分解后能产生
分解后能产生 并释放出大量能量,推测其用途可为
并释放出大量能量,推测其用途可为_______ 。
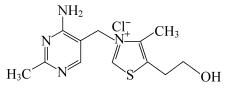
(2)①维生素 可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
可作为辅酶参与糖的代谢,并有保护神经系统的作用,该物质的结构简式如图所示:
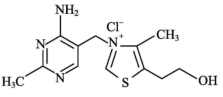
以下关于维生素 的说法正确的是
的说法正确的是_______ 。
a.只含σ键和π键
b.既有共价键又有离子键
c.既含有极性键又含有非极性键
②维生素 燃烧可生成
燃烧可生成 、
、 、
、 、
、 、
、 、
、 等物质,这些物质中属于非极性分子的化合物有
等物质,这些物质中属于非极性分子的化合物有_______ 。
(3)液氨常被用作制冷剂,若不断地升高温度,实现“液氨 氨气
氨气 氮气和氢气
氮气和氢气 氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①
氮原子和氢原子”的变化,在变化的各阶段被破坏的粒子间的相互作用是①_______ ;②极性键;③_______ 。
(1)科学家目前合成了

(2)①维生素

以下关于维生素
a.只含σ键和π键
b.既有共价键又有离子键
c.既含有极性键又含有非极性键
②维生素
(3)液氨常被用作制冷剂,若不断地升高温度,实现“液氨
21-22高二下·吉林通化·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

 )中碳原子轨道杂化类型是
)中碳原子轨道杂化类型是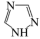
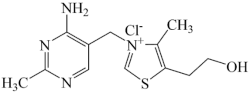
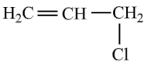 )中碳原子轨道杂化类型是
)中碳原子轨道杂化类型是