解答题-原理综合题 适中0.65 引用1 组卷315
Ⅰ.合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献之一,其反应原理为:
 。
。
(1)已知下列数据:
则N-H键的键能是_______ kJ/mol。
(2)T℃时,在2L的密闭容器中发生上述合成氨反应,开始投入 和一定量的
和一定量的 ,体系中
,体系中 随时间的变化如下表:
随时间的变化如下表:
①用 表示从0~2min内该反应的平均速率
表示从0~2min内该反应的平均速率
_______ 。
②第4min时 的体积分数为
的体积分数为_______ 。(保留三位有效数字)
③下列叙述中能说明上述反应达到平衡状态的是_______ 。(用字母表示)
a.该条件下生成 同时生成
同时生成
b.该条件下气体的平均相对分子质量保持不变
c.该条件下混合气体的密度保持不变
d.
Ⅱ.如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,若两电极分别为Zn和石墨棒,则:

(3)X为_______ (填“Zn”或“石墨棒”)。
(4)Y上发生的电极反应为_______ 。
(5) 移向
移向_______ 电极(填“Zn”或“石墨棒”)。
(1)已知下列数据:
| 化学键 | H-H | |
| 键能(kJ/mol) | 436 | 946 |
则N-H键的键能是
(2)T℃时,在2L的密闭容器中发生上述合成氨反应,开始投入
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.40 | 0.20 | 0.14 | 0.12 | 0.12 | 0.12 |
①用
②第4min时
③下列叙述中能说明上述反应达到平衡状态的是
a.该条件下生成
b.该条件下气体的平均相对分子质量保持不变
c.该条件下混合气体的密度保持不变
d.
Ⅱ.如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,若两电极分别为Zn和石墨棒,则:

(3)X为
(4)Y上发生的电极反应为
(5)
21-22高一下·辽宁·期末
类题推荐
合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
①5~10 min内,生成NH3的平均反应速率是_______ mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是_______ (填字母序号)。
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是_______ 。
(2)合成氨的反应原理为:N2(g)+3H2(g) 2NH3(g) ΔH。
2NH3(g) ΔH。
相关化学键键能数据如下:
由此计算ΔH=_______ kJ/mol,低温下,合成氨反应_______ (填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g) 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g) N2(g)+3H2(g)的活化能Ea2=
N2(g)+3H2(g)的活化能Ea2=_______ kJ/mol。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g) 2NO(g) △H =
2NO(g) △H = _______ kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应_______ (填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=_______ (只列算式不计算)。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
| 时间 物质的量 | 5 min | 10 min | 15 min | 20 min | 25 min |
| n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
| n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
| n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
①5~10 min内,生成NH3的平均反应速率是
②下列能作为判断该反应达到化学平衡状态的依据是
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是
(2)合成氨的反应原理为:N2(g)+3H2(g)
 2NH3(g) ΔH。
2NH3(g) ΔH。相关化学键键能数据如下:
| 化学键 | H—H | N≡N | N—H |
| E /(kJ/mol) | 436 | 946 | 391 |
由此计算ΔH=
 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g) N2(g)+3H2(g)的活化能Ea2=
N2(g)+3H2(g)的活化能Ea2=(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol反应II:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol①该条件下,N2(g)+O2(g)
 2NO(g) △H =
2NO(g) △H = ②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应
工业合成氨是人类科学技术上的一项重大突破,是化学对社会发展的巨大贡献之一。在催化剂作用下发生
 ,回答下列问题:
,回答下列问题:
(1)依据键能信息,
__________  。
。
(2)其他条件不变,下列能加快反应速率,并提高 的平衡转化率的是__________(填字母)。
的平衡转化率的是__________(填字母)。
(3)恒温恒容条件下,下列能说明该反应已达到平衡状态的是____(填字母)
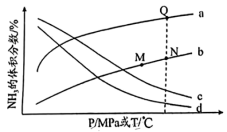
(4)在恒容密闭容器中,初始时氮气和氢气的体积比是1:3,300℃、500℃条件下平衡时氨的体积分数随压强( )的变化示意图,以及10MPa、30MPa条件下平衡时氨的体积分数随温度(
)的变化示意图,以及10MPa、30MPa条件下平衡时氨的体积分数随温度( )的变化示意图如下。
)的变化示意图如下。__________ (填“a”“b”“c”或“d”)。
②M、N、Q三点对应的平衡常数分别为 、
、 、
、 ,三平衡常数的大小关系为
,三平衡常数的大小关系为_________ 。
(5)400℃、 条件下,初始时氮气和氢气的体积比是
条件下,初始时氮气和氢气的体积比是 ,平衡时氨气的体积分数为60%,则该条件下反应的压强平衡常数
,平衡时氨气的体积分数为60%,则该条件下反应的压强平衡常数
__________  。
。
(6)利用质子传导固态电池合成氨示意图如下,生成氨气的电极反应式为____________________ 。 用于制氨水和铵盐。常温下,将浓度均为
用于制氨水和铵盐。常温下,将浓度均为 氨水和
氨水和 溶液等体积混合,混合溶液显
溶液等体积混合,混合溶液显__________ (填“酸性”“碱性”或“中性”),混合溶液
__________ 。已知:常温下
化学键 | |||
键能(kJ/mol) | 946 | 436 | 391 |
(2)其他条件不变,下列能加快反应速率,并提高
| A.固定体系体积,加大 | B.升高反应体系的温度 |
| C.降低平衡体系的压强 | D.改用效果更好的催化剂 |
| A.气体的密度保持不变 | B. |
| C.气体的平均摩尔质量保持不变 | D.消耗 |
②M、N、Q三点对应的平衡常数分别为
(5)400℃、
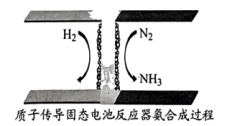
(6)利用质子传导固态电池合成氨示意图如下,生成氨气的电极反应式为
氢能是一种非常清洁的能源,氨分解制备氢气是一种技术先进和经济可行的工艺。恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应 ,测得不同起始浓度和催化剂表面积下
,测得不同起始浓度和催化剂表面积下 的浓度随时间的变化如下表所示:
的浓度随时间的变化如下表所示:
回答下列问题:
(1)已知 、
、 、
、 的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则
的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则 完全分解吸收的能量为
完全分解吸收的能量为_______ kJ。
(2)实验①中20~40min,
_______ 。
(3)实验③达到平衡后, 的体积分数约为
的体积分数约为_______ (保留三位有效数字)。
(4)下列能说明该反应达到平衡状态的是_______ (填序号)
a. b.
b. 保持不变
保持不变
c. 保持不变 d.容器内混合气体密度保持不变
保持不变 d.容器内混合气体密度保持不变
e.容器内混合气体平均相对分子质量保持不变
(5)关于上述实验,下列说法正确的是_______ (填序号)
a.实验②,60min时处于平衡状态
b.相同条件下,增加氨气的浓度,反应速率增大
c.相同条件下,增加催化剂的表面积,反应速率增大
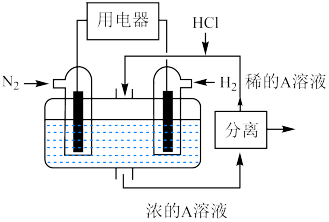
(6)有人设想以 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为_______ ,A为_______ (填化学式)。
| 编号 | 时间min 表面积/ | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
(1)已知
(2)实验①中20~40min,
(3)实验③达到平衡后,
(4)下列能说明该反应达到平衡状态的是
a.
c.
e.容器内混合气体平均相对分子质量保持不变
(5)关于上述实验,下列说法正确的是
a.实验②,60min时处于平衡状态
b.相同条件下,增加氨气的浓度,反应速率增大
c.相同条件下,增加催化剂的表面积,反应速率增大
(6)有人设想以

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


