填空题 较难0.4 引用2 组卷406
许多钠的化合物的水溶液呈碱性,这些化合物之间往往可以相互转化。
(1)写出 的电子式
的电子式___________ ; 所含化学键的类型有
所含化学键的类型有___________ (填写下列字母)。
a.极性共价键 b.非极性共价键 c.离子键 d.金属键
(2) 金属钠完全氧化为
金属钠完全氧化为 的焓变为
的焓变为 ,而完全氧化为
,而完全氧化为 的焓变为
的焓变为 ,则
,则
___________  (填“>”、“<”或“=”)。如果以
(填“>”、“<”或“=”)。如果以 为原料制备
为原料制备 固体,样品往往混有一定量的
固体,样品往往混有一定量的 。可以通过测定固体样品加热前后的质量差来测定该样品的纯度。
。可以通过测定固体样品加热前后的质量差来测定该样品的纯度。
(3)该固体样品应在___________ (填仪器名称)中加热至恒重。该过程主要发生的化学方程式为___________ 。
(4)对某一样品做四组平行实验,数据结果如下:
则该样品中 质量分数为
质量分数为___________ (表示成百分数,精确到 )。
)。
(5)若 质量分数标准值为
质量分数标准值为 ,则上述实验中可能存在的问题有
,则上述实验中可能存在的问题有___________ (填写下列字母)
a.盛放样品的容器有受热分解杂质 b.盛放样品的容器有热稳定杂质
c.加热前洗净的容器未完全干燥 d.样品在加热后冷却时未放置于干燥器
e.加热时有样品溅出 f.固体样品未充分受热,反应进行不完全
(1)写出
a.极性共价键 b.非极性共价键 c.离子键 d.金属键
(2)
(3)该固体样品应在
(4)对某一样品做四组平行实验,数据结果如下:
| 所测物理量 | 第一组 | 第二组 | 第三组 | 第四组 |
| 容器质量/g | 17.221 | 18.565 | 18.652 | 17.094 |
| 加热前容器与样品质量/g | 24.864 | 26.800 | 26.935 | 24.338 |
| 恒重后容器与样品质量/g | 22.209 | 23.936 | 23.992 | 21.823 |
(5)若
a.盛放样品的容器有受热分解杂质 b.盛放样品的容器有热稳定杂质
c.加热前洗净的容器未完全干燥 d.样品在加热后冷却时未放置于干燥器
e.加热时有样品溅出 f.固体样品未充分受热,反应进行不完全
21-22高一下·上海宝山·期末
类题推荐
氧化镁在医药,建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为 ,含少量
,含少量 )为原料制备高纯氧化镁的实验流程如下:
)为原料制备高纯氧化镁的实验流程如下:

(1)加入 氧化时,发生反应的化学方程式为
氧化时,发生反应的化学方程式为_______ 。
(2)氨水的作用是_______ 。
煅烧过程存在以下反应: ;
;
 ;
;

 。
。
利用下图装置对煅烧产生的气体进行分步吸收或收集。

(3)A中得到的物质是_______ ,D中收集的气体是_______ (填化学式)。B中盛放的溶液是_______ (填序号)。
a.NaOH溶液 b. 溶液 c.稀硝酸 d.
溶液 c.稀硝酸 d. 溶液
溶液
(4)从滤液中得到 粗晶体的实验操作依次是
粗晶体的实验操作依次是_______ (填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的 晶体必须进行的操作是
晶体必须进行的操作是_______ (填操作名称)。
(5)已知: 在200℃时失去全部结晶水,成为粉状无水硫酸镁,脱水物放置于潮湿的空气中又能重新吸收水蒸气,某次实验测定
在200℃时失去全部结晶水,成为粉状无水硫酸镁,脱水物放置于潮湿的空气中又能重新吸收水蒸气,某次实验测定 晶体中结晶水含量,得到以下数据:
晶体中结晶水含量,得到以下数据:
测得结晶水n=_______ (保留2位小数),该实验过程产生误差的原因可能是(填写字母)_______
A.加热前称量时容器未完全干燥 B.晶体表而已经少量失水
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失

(1)加入
(2)氨水的作用是
煅烧过程存在以下反应:
利用下图装置对煅烧产生的气体进行分步吸收或收集。

(3)A中得到的物质是
a.NaOH溶液 b.
(4)从滤液中得到
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的
(5)已知:
| 加热前质量(g) | 加热后质量(g) | ||
| 坩埚 | 坩埚+晶体 | 坩埚+无水硫酸镁 | |
| 第一次 | 15.688 | 18.370 | 16.962 |
| 第二次 | 15.688 | 18.486 | 17.002 |
A.加热前称量时容器未完全干燥 B.晶体表而已经少量失水
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失
测定硫酸铜晶体(CuSO4·xH2O)中x值的实验过程如下。完成下列填空:
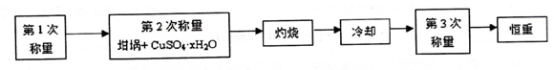
(1)设待测硫酸铜晶体的化学式为CuSO4·xH2O ,则该硫酸铜晶体受热失去全部结晶水的化学方程式为_____________ 。
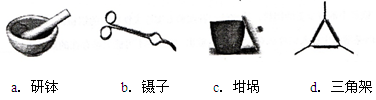
(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是_________ 。(填序号)
(3)“冷却”操作应在___________ (填仪器名称)中进行,“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是_________________________ 。
(4)恒重操作的目的是________________ 。
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是__________ 。(填序号)
a.坩埚未完全干燥 b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质 d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
①若无需再进行第三次称量,则a的数值范围应为___________ 。
②若加热后坩埚与固体总质量为18.631g,实测值x=____________ (保留两位小数)
③若理论值x=5,则该实验的相对误差是__________ 。

(1)设待测硫酸铜晶体的化学式为CuSO4·xH2O ,则该硫酸铜晶体受热失去全部结晶水的化学方程式为

(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是
(3)“冷却”操作应在
(4)恒重操作的目的是
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是
a.坩埚未完全干燥 b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质 d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 11.721g | 22.692g | 18.631g | a |
①若无需再进行第三次称量,则a的数值范围应为
②若加热后坩埚与固体总质量为18.631g,实测值x=
③若理论值x=5,则该实验的相对误差是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 Fe2++
Fe2++ ===
===

