解答题-原理综合题 较易0.85 引用1 组卷564
无论是在环境保护领域还是在工农业生产领域,氮及其化合物一直是我国科研重点。回答下列问题:
(1)下列过程属于氮的固定过程的是_______(填选项字母)。
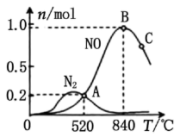
(2)消除汽车尾气中的氮氧化合物的原理之一为 。一定温度下,向体积为5L的刚性密闭容器中充入0.5molNO和0.5molCO,发生上述反应,测得部分气体的物质的量随时间变化关系如图所示:
。一定温度下,向体积为5L的刚性密闭容器中充入0.5molNO和0.5molCO,发生上述反应,测得部分气体的物质的量随时间变化关系如图所示:
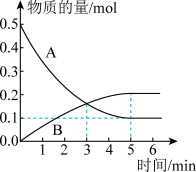
①其中B表示_______ (填“ ”或“
”或“ ”)物质的量的变化曲线。
”)物质的量的变化曲线。
②该温度下,反应开始至5min时该反应的平均反应速率
_______ 。
③3min时,反应_______ (填“达到”或“未达到”)化学平衡,6min时,正反应速率_______ (填“>”“<”或“=”)逆反应速率。
④下列情况能说明该反应达到平衡状态的是_______ (填选项字母)。
A.化学反应速率
B.CO与 的物质的量之和不再发生变化
的物质的量之和不再发生变化
C.容器内气体压强不再发生变化
D.容器内混合气体密度不再发生变化
(3)实验室用NaOH溶液对氮氧化合物进行尾气吸收,例如NaOH溶液可将 转化为
转化为 和
和 。该吸收过程中发生反应的离子方程式为
。该吸收过程中发生反应的离子方程式为_______ 。
(4)某固体氧化物为电解质的新型燃料电池是以液态肼(N2H4)为燃料,氧气为氧化剂构成,其原理示意图如图所示。
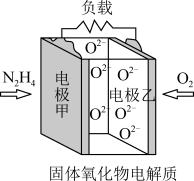
该电池的正极为_______ (填“电极甲”或“电极乙”,下同);电池工作时, 向
向_______ 移动。
(1)下列过程属于氮的固定过程的是_______(填选项字母)。
| A.工业合成氨 |
| B.工业利用氨气合成硝酸 |
| C.雷雨天中氮气与氧气生成氮氧化合物 |
| D.通过碱性试剂将气态的氮氧化合物转化为固态含氮化合物 |

①其中B表示
②该温度下,反应开始至5min时该反应的平均反应速率
③3min时,反应
④下列情况能说明该反应达到平衡状态的是
A.化学反应速率
B.CO与
C.容器内气体压强不再发生变化
D.容器内混合气体密度不再发生变化
(3)实验室用NaOH溶液对氮氧化合物进行尾气吸收,例如NaOH溶液可将
(4)某固体氧化物为电解质的新型燃料电池是以液态肼(N2H4)为燃料,氧气为氧化剂构成,其原理示意图如图所示。

该电池的正极为
21-22高一下·广东韶关·期末
类题推荐
CH3OH是无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是___________ (填字母)。
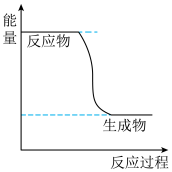
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.H2的生成速率与CH3OH的消耗速率之比为1
(2)化学键的键能如表所示,若1molCH3OH(g)完全转化为1molCO2(g)和2molH2(g),放出能量___________ kJ。
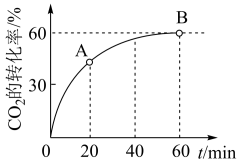
(3)某温度下,将10molCH3OH和4molO2充入2L的密闭容器中,经过5min反应达到平衡,测得c(O2)=0.4mol/L,5min内平均反应速率v(H2)=________ ,则CH3OH的转化率为_________ 。
(4)CH3OH燃料电池是目前较成熟的燃料电池之一,由甲醇、空气(氧气)、KOH(电解质溶液)构成其中负极反应式为CH3OH+8OH--6e-= +6H2O,则电池放电时通入空气的电极反应式为
+6H2O,则电池放电时通入空气的电极反应式为___________ ,电池放电时,电解质溶液的碱性逐渐___________ (填“增加“减小”或“不变”)若线路中转移0.2mol电子,则消耗的O2在标准状况下的体积为___________ L。
(5)工业上可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g),在体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。
①下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.CH3OH的质量分数在混合气体中保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
②若已知生成2.24LCH3OH(g)(已折算为标准状况下)时放出热量为4.9kJ,固定的密闭容器中投入1molCO和2molH2气体充分反应实际放热总量小于49kJ其原因是___________ 。
③下列措施不使提高反应速率的是___________ 。
A.升高温度
B.选择高效催化剂
C.向容器中充入一定量的氩气增大体系压强
D.及时分离出甲醇
(1)已知CH3OH(g)+

a.CH3OH转变成H2的过程是一个吸收能量的过程
b.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.H2的生成速率与CH3OH的消耗速率之比为1
(2)化学键的键能如表所示,若1molCH3OH(g)完全转化为1molCO2(g)和2molH2(g),放出能量
| 化学键 | C一H | C一O | O一H | O=O | C=O | H一H |
| 键能/kJ | 44 | 360 | 464 | 498 | 799 | 416 |
(4)CH3OH燃料电池是目前较成熟的燃料电池之一,由甲醇、空气(氧气)、KOH(电解质溶液)构成其中负极反应式为CH3OH+8OH--6e-=
(5)工业上可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g),在体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。
①下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.CH3OH的质量分数在混合气体中保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
②若已知生成2.24LCH3OH(g)(已折算为标准状况下)时放出热量为4.9kJ,固定的密闭容器中投入1molCO和2molH2气体充分反应实际放热总量小于49kJ其原因是
③下列措施不使提高反应速率的是
A.升高温度
B.选择高效催化剂
C.向容器中充入一定量的氩气增大体系压强
D.及时分离出甲醇
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网