填空题 适中0.65 引用2 组卷158
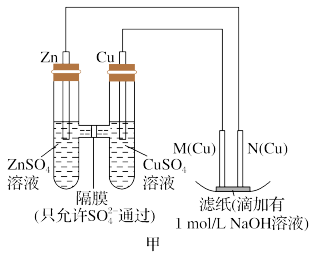
某研究性学习小组的同学设计了一个原电池如图所示:
Ⅰ.根据上述原电池,请回答下列问题:
(1)Ag电极是_______ 极(填“正”或“负”),铜电极上发生的电极反应式是_______ 。
(2)溶液中的NO3-的移动方向为_______ (填“自右向左” 或“自左向右”)。
Ⅱ.研究性学习小组的同学们对该原电池中应出现的实验现象进行了预测,他们认为应该有这些现象:
①Cu电极要发生溶解;
②电流计中指针发生偏转;
③Ag电极上有固体物质析出;
④……
请回答下列问题:
(3)预测④的现象为_______ 。
(4)但同学们发现,除了以上预测的现象之外,在银电极附近出现了无色气泡,一段时间后银电极上方的空气中出现红棕色。该红棕色气体为_______ 。
(5)为了探究出现该现象的原因,同学们测定了电解质溶液的pH,发现溶液中的H+浓度为0.80mol/L,据此推断,原电池体系中应存在化学反应_______ (写出该反应的离子方程式)。
(6)同学们通过查阅资料了解到,常温下1.00mol/L的AgNO3溶液pH为5(即H+ 为10-5mol/L),说明装置1中硝酸银溶液已用硝酸进行了酸化。于是又设计了另一个原电池(装置2)以说明上述原电池中的确存在这一反应,如图所示,以下最宜 选用为该电池电解质溶液的是_______ (填标号)。
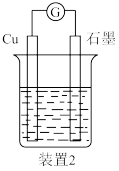
a.0.80mol/L HNO3
b.0.80mol/L HCl和1.00 mol/L NaNO3的混合液
c.0.40mol/L H2SO4和1.80mol/L NaNO3的混合溶液
d.0.80mol/L CH3COOH和1.00mol/L NaNO3的混合溶液
通过实验,发现该电池在一段时间后出现与(2)中相同的现象,说明原电池中的确存在该反应。
Ⅲ.为了进一步探究电解质溶液的浓度对电池反应速率的影响,同学们准备了两组装置,并分别在它们的银电极上安装了重力传感器,其中一组电解质溶液为500mL 1.00mol/L AgNO3溶液;另一组为500mL 0.50mol/L AgNO3溶液(两组硝酸银溶液均已净化,为单一组分),由传感器所得数据作图如图:
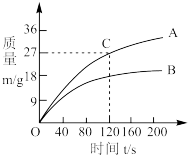
(7)其中代表电解质为0.50mol/L AgNO3溶液的一组的曲线是_______ (填“A”或“B”) 。
(8)对于A曲线,以硝酸银溶液浓度变化来表示120s内的反应速率υ=_______ (保留2位有效数字,忽略溶液的体积变化)。

Ⅰ.根据上述原电池,请回答下列问题:
(1)Ag电极是
(2)溶液中的NO3-的移动方向为
Ⅱ.研究性学习小组的同学们对该原电池中应出现的实验现象进行了预测,他们认为应该有这些现象:
①Cu电极要发生溶解;
②电流计中指针发生偏转;
③Ag电极上有固体物质析出;
④……
请回答下列问题:
(3)预测④的现象为
(4)但同学们发现,除了以上预测的现象之外,在银电极附近出现了无色气泡,一段时间后银电极上方的空气中出现红棕色。该红棕色气体为
(5)为了探究出现该现象的原因,同学们测定了电解质溶液的pH,发现溶液中的H+浓度为0.80mol/L,据此推断,原电池体系中应存在化学反应
(6)同学们通过查阅资料了解到,常温下1.00mol/L的AgNO3溶液pH为5(即H+ 为10-5mol/L),说明装置1中硝酸银溶液已用硝酸进行了酸化。于是又设计了另一个原电池(装置2)以说明上述原电池中的确存在这一反应,如图所示,以下

a.0.80mol/L HNO3
b.0.80mol/L HCl和1.00 mol/L NaNO3的混合液
c.0.40mol/L H2SO4和1.80mol/L NaNO3的混合溶液
d.0.80mol/L CH3COOH和1.00mol/L NaNO3的混合溶液
通过实验,发现该电池在一段时间后出现与(2)中相同的现象,说明原电池中的确存在该反应。
Ⅲ.为了进一步探究电解质溶液的浓度对电池反应速率的影响,同学们准备了两组装置,并分别在它们的银电极上安装了重力传感器,其中一组电解质溶液为500mL 1.00mol/L AgNO3溶液;另一组为500mL 0.50mol/L AgNO3溶液(两组硝酸银溶液均已净化,为单一组分),由传感器所得数据作图如图:

(7)其中代表电解质为0.50mol/L AgNO3溶液的一组的曲线是
(8)对于A曲线,以硝酸银溶液浓度变化来表示120s内的反应速率υ=
21-22高一下·重庆·期末
类题推荐
在学习氧化还原反应时,某同学提出 具有较强氧化性,
具有较强氧化性, 具有较强还原性,二者也可发生氧化还原反应。为验证这个问题,该学生设计了系列实验。
具有较强还原性,二者也可发生氧化还原反应。为验证这个问题,该学生设计了系列实验。
(1)研究 溶液与
溶液与 溶液反应产物。向盛有
溶液反应产物。向盛有 溶液的试管中加入
溶液的试管中加入 溶液,振荡试管,向其中加入
溶液,振荡试管,向其中加入______ ,溶液无明显变化。
(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)验证 的氧化性。将光亮的铁丝伸入
的氧化性。将光亮的铁丝伸入 溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的
溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的 除尽后,进行了如下实验。可选用试剂:①
除尽后,进行了如下实验。可选用试剂:① 溶液 ②
溶液 ② 溶液 ③酸性
溶液 ③酸性 溶液 ④
溶液 ④ 溶液。
溶液。
请完成下表:
(实验结论)铁的氧化产物为 和
和 ,则
,则 氧化性强于
氧化性强于 ,已知
,已知 氧化性强于
氧化性强于 ,则
,则 可与
可与 发生氧化还原反应。
发生氧化还原反应。
另一同学用pH计测得常温该硝酸银溶液的pH为5.50,于是该同学对实验结论提出质疑。你认为他提出质疑的理由可能是______ 。
(3)通过原电池原理探究 与
与 之间的氧化还原反应
之间的氧化还原反应

按图设计原电池。电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近,根据下表数据,盐桥中应选择______ 作为电解质。
实验开始后,电流表指针发生偏转,正极电极表面有光亮的银析出,则该原电池的负极反应方程式为______ 。
(实验结论)______ 。
(4)查阅资料可知常温反应: ;
; 。试从速率与平衡两个角度解释
。试从速率与平衡两个角度解释 溶液与
溶液与 溶液反应混合只发生沉淀反应而无明显氧化还原反应的可能原因
溶液反应混合只发生沉淀反应而无明显氧化还原反应的可能原因______ 。
(1)研究
(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)验证
请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽 | 存在 | |
| 取少量除尽 | 存在 |
另一同学用pH计测得常温该硝酸银溶液的pH为5.50,于是该同学对实验结论提出质疑。你认为他提出质疑的理由可能是
(3)通过原电池原理探究

按图设计原电池。电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近,根据下表数据,盐桥中应选择
| 阳离子 | 阴离子 | ||
| 4.07 | 4.61 | ||
| 5.19 | 7.40 | ||
| 6.59 | 7.91 | ||
| 7.62 | 8.27 |
(实验结论)
(4)查阅资料可知常温反应:
在学习氧化还原反应时,某同学提出Ag+具有较强氧化性,I-具有较强还原性,二者也可发生氧化还原反应。为验证这个问题,该学生设计了系列实验。
(1)研究AgNO3溶液与KI溶液反应产物
向盛有1mL1mol/LAgNO3溶液的试管中加入1mL1mol/LKI溶液,振荡试管,向其中加入___ ,溶液无明显变化。(提示:若发生氧化还原反应,I-应被氧化为单质)
(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)验证Ag+的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液②NaOH溶液③酸性KMnO4溶液。请完成下表:
(实验结论)铁的氧化产物为Fe2+和Fe3+,则Ag+氧化性强于Fe3+。
另一同学用pH计测得常温该硝酸银溶液的pH为5.50,于是该同学对实验结论提出质疑。你认为他提出质疑的理由可能是____ 。
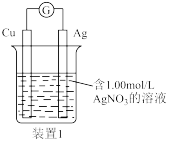
(3)电池原理探究Ag+与I-之间的氧化还原反应
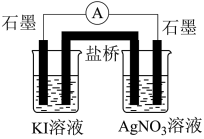
按图设计原电池。电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。读懂文中划线部分内容,请回答以下问题:
根据下表数据,盐桥中应选择_____ 作为电解质。
(4)已知Cl2能氧化+4价的硫为+6价的硫。请写出Na2SO3溶液和Cl2反应反应的离子方程式____ 。
(5)硫酸亚铁受热可按下式分解:aFeSO4=bFeO+cFe2O3+dSO3+eSO2+fO2,a、b、c、d、e、f为待定系数,若d:e:f=3:4:1,则b:c=_____ 。
(1)研究AgNO3溶液与KI溶液反应产物
向盛有1mL1mol/LAgNO3溶液的试管中加入1mL1mol/LKI溶液,振荡试管,向其中加入
(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)验证Ag+的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液②NaOH溶液③酸性KMnO4溶液。请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 存在Fe3+ | |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴 | 存在Fe2+ |
另一同学用pH计测得常温该硝酸银溶液的pH为5.50,于是该同学对实验结论提出质疑。你认为他提出质疑的理由可能是
(3)电池原理探究Ag+与I-之间的氧化还原反应

按图设计原电池。电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。读懂文中划线部分内容,请回答以下问题:
根据下表数据,盐桥中应选择
| 阳离子 | u∞×108(m2∙s-1∙V-1) | 阴离子 | u∞×108(m2∙s-1∙V-1) |
| Li+ | 4.07 | 4.61 | |
| Na+ | 5.19 | 7.40 | |
| Ca2+ | 6.59 | Cl- | 7.91 |
| K+ | 7.62 | 8.27 |
(5)硫酸亚铁受热可按下式分解:aFeSO4=bFeO+cFe2O3+dSO3+eSO2+fO2,a、b、c、d、e、f为待定系数,若d:e:f=3:4:1,则b:c=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网