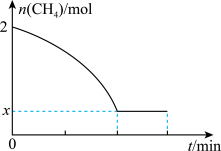
解答题-原理综合题 较难0.4 引用1 组卷125
氯乙烯是制备塑料的重要中间体,可通过乙炔选择性催化制备。已知:
I.C2H2(g)+HCl(g) C2H3Cl(g) △H1=-124.8kJ·mol-1
C2H3Cl(g) △H1=-124.8kJ·mol-1
II.C2H2(g)+2HCl(g) C2H4Cl2(g) △H2=-179.3kJ·mol-1
C2H4Cl2(g) △H2=-179.3kJ·mol-1
(1)HCl(g)+C2H3Cl(g) C2H4Cl2(g)正反应活化能为25.8kJ/mol,则其逆反应的活化能为
C2H4Cl2(g)正反应活化能为25.8kJ/mol,则其逆反应的活化能为____ 。
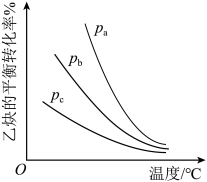
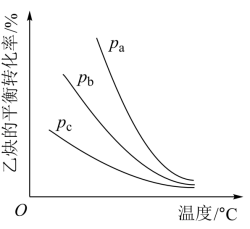
(2)在体积可变的密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。P1、P2、P3由大到小的顺序为____ 。
(3)一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),假设只发生反应I和II。实验测得反应前容器内压强为P0Pa,5min达到平衡时C2H4Cl2(g)、HCl(g)的分压分别为P1Pa、P2Pa。
①0~5min内,反应I和反应II中HCl的总的消耗速率v(HCl)=____ Pa·min-1
②反应II的平衡常数Kp=____ (用含P1、P2的代数式表示)
(4)电化学腐蚀法可有效将废水中的三氯乙烯转化为乙烯。利用活性纳米Fe电化学腐蚀处理酸性三氯乙烯(C2HCl3)废水的过程如图。定义单位时间内纳米Fe释放的总电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。
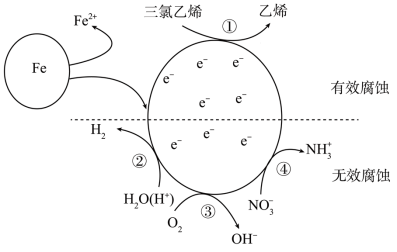
①上述电化学腐蚀过程①的电极反应为____ 。
②在处理过程中,当消耗amol纳米Fe时,产生bL的乙烯气体(标准状况),则该电化学腐蚀过程的电流效率η=____ (用含a、b的代数式表示)。[已知:η= ×100%]
×100%]
I.C2H2(g)+HCl(g)
II.C2H2(g)+2HCl(g)
(1)HCl(g)+C2H3Cl(g)
(2)在体积可变的密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。P1、P2、P3由大到小的顺序为

(3)一定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入C2H2(g)和HCl(g),假设只发生反应I和II。实验测得反应前容器内压强为P0Pa,5min达到平衡时C2H4Cl2(g)、HCl(g)的分压分别为P1Pa、P2Pa。
①0~5min内,反应I和反应II中HCl的总的消耗速率v(HCl)=
②反应II的平衡常数Kp=
(4)电化学腐蚀法可有效将废水中的三氯乙烯转化为乙烯。利用活性纳米Fe电化学腐蚀处理酸性三氯乙烯(C2HCl3)废水的过程如图。定义单位时间内纳米Fe释放的总电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。

①上述电化学腐蚀过程①的电极反应为
②在处理过程中,当消耗amol纳米Fe时,产生bL的乙烯气体(标准状况),则该电化学腐蚀过程的电流效率η=
21-22高二下·四川成都·阶段练习
类题推荐
氯乙烯是制备塑料的重要中间体,可通过乙炔选择性催化加氢制备。已知:
I.

II.

III.

VI.部分化学键的键能如表所示。
回答下列问题
(1)表中
__________ 。
(2)在体积可变的密闭容器中以物质的量之比为1∶1充入 和
和 ,分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。
,分别在不同压强下发生反应,实验测得乙炔的平衡转化率与温度的关系如图所示。 、
、 、
、 由大到小的顺序为
由大到小的顺序为__________ 。随温度升高,三条曲线逐渐趋于重合的原因为__________ 。
(3)—定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入 和
和 ,假设只发生反应I和II。实验测得反应前容器内压强为
,假设只发生反应I和II。实验测得反应前容器内压强为 ,10min达到平衡时
,10min达到平衡时 、
、 的分压分别为
的分压分别为 、
、 。
。
①0~10min内,HCl的总消耗速率
__________ Pa/min(用分压表示)。
②反应I的平衡常数
__________  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(4)科学家发现反应I在催化剂Au/C作用下的反应历程如图所示。“2→3”的化学方程式可表示为:
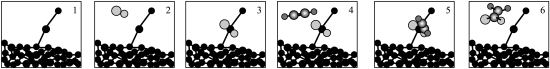
①“4→5”的化学方程式为__________ 。
②反应物在催化剂表面经历过程“扩散→吸附(活性位点)→表面反应→脱附”。若保持体系中 分压不变,HCl分压过高时反应催化效率降低的可能原因是
分压不变,HCl分压过高时反应催化效率降低的可能原因是__________ 。
I.
II.
III.
VI.部分化学键的键能如表所示。
化学键 | C-C | C=C | C-H | C-Cl | H-Cl |
键能(kJ/mol) | 347.7 | x | 413.4 | 340.2 | 431.8 |
(1)表中
(2)在体积可变的密闭容器中以物质的量之比为1∶1充入

(3)—定温度下,向盛放催化剂的恒容密闭容器中以物质的量之比为1∶1充入
①0~10min内,HCl的总消耗速率
②反应I的平衡常数
(4)科学家发现反应I在催化剂Au/C作用下的反应历程如图所示。“2→3”的化学方程式可表示为:

①“4→5”的化学方程式为
②反应物在催化剂表面经历过程“扩散→吸附(活性位点)→表面反应→脱附”。若保持体系中
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网