解答题-结构与性质 适中0.65 引用1 组卷76
早在1914年就有人发现,引入有机基团可降低离子化合物的熔点,如 的熔点只有12℃,比
的熔点只有12℃,比 的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。
的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。
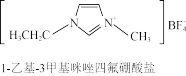
(1)1-乙基-3甲基咪唑四氟硼酸盐中涉及的元素除氢元素外,其余元素均位于元素周期表的___________ 区,基态F原子核外电子的运动状态有___________ 种。
(2) 极易溶于水且水溶液呈碱性的原因与氢键有关,用“…”表示氢键,结合
极易溶于水且水溶液呈碱性的原因与氢键有关,用“…”表示氢键,结合 的电离推测
的电离推测 可能的结构式为
可能的结构式为___________ 。
(3)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到 。
。
 的熔沸点如下表所示
的熔沸点如下表所示
20℃时, 、
、 、
、 、
、 呈液态的是
呈液态的是___________ (填化学式),熔沸点依次升高的原因是___________ 。
(4)下列有关该离子液体说法正确的是___________。
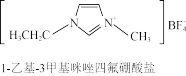
(1)1-乙基-3甲基咪唑四氟硼酸盐中涉及的元素除氢元素外,其余元素均位于元素周期表的
(2)
(3)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
(4)下列有关该离子液体说法正确的是___________。
| A.该离子液体的阳离子中C原子和N原子的杂化轨道类型均为 |
| B.离子液体中C、N、H三种元素的电负性由大到小的顺序为 |
| C.该离子液体的熔沸点低于氯化钠晶体,是因为阴阳离子体积较大,使得阴阳离子间距离较大,离子键较弱 |
| D.离子液体中微粒间作用力较大,一般比有机溶剂难挥发,是很好的“绿色”溶剂 |
21-22高二下·山西运城·期末
类题推荐
填空。
(1)非金属氟化物在生产、生活和科研中应用广泛。
①OF2分子的空间结构为___________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是___________ 。
②Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___________ ,下列对XeF2中心原子杂化方式推断合理的是___________ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d
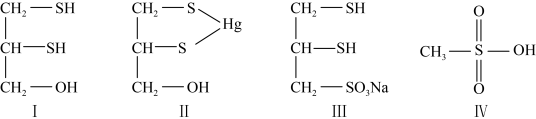
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。
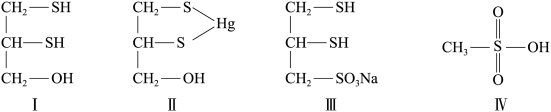
①H2S、CH4、H2O的沸点由高到低顺序为___________ 。
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
③汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是___________ 。
(3)硅和卤素单质反应可以得到SiX4。SiX4的熔、沸点如下表:
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___________ (填化学式),沸点依次升高的原因是___________ ,气态SiX4分子的空间结构是___________ 。
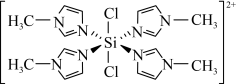
②SiCl4与N甲基咪唑(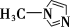 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
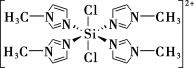
N甲基咪唑分子中碳原子的杂化轨道类型为___________ ,H、C、N的电负性由大到小的顺序为___________ ,1个M2+中含有___________ 个σ键。
(1)非金属氟化物在生产、生活和科研中应用广泛。
①OF2分子的空间结构为
②Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
A.sp B.sp2 C.sp3 D.sp3d
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。

①H2S、CH4、H2O的沸点由高到低顺序为
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
③汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是
(3)硅和卤素单质反应可以得到SiX4。SiX4的熔、沸点如下表:
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
②SiCl4与N甲基咪唑(
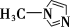 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
N甲基咪唑分子中碳原子的杂化轨道类型为
请回答下列问题:
(1)非金属氟化物在生产、生活和科研中应用广泛。OF2分子的空间结构为___________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是___________ 。
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。___________ 。
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(3)硅和卤素单质反应可以得到SiX4.SiX4的熔、沸点如下表:
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___________ (填化学式),气态SiX4分子的空间结构是___________ 。___________ ,H、C、N的电负性由大到小的顺序为___________ ,1个M2+中含有___________ 个σ键。
(1)非金属氟化物在生产、生活和科研中应用广泛。OF2分子的空间结构为
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(3)硅和卤素单质反应可以得到SiX4.SiX4的熔、沸点如下表:
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
②SiCl4与N甲基咪唑(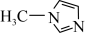 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
明代科学家宋应星在《天工开物》中写道:“凡玉入中国,贵者尽出于田、葱岭”。和田玉的主要化学成分是含水的钙镁硅酸盐。回答下列问题:
(1)某同学所画基态镁原子的核外电子排布图为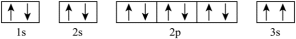 ,该电子排布图违背了
,该电子排布图违背了___________ 。
(2) 四种元素的第一电离能由大到小的顺序是
四种元素的第一电离能由大到小的顺序是___________ ; 的空间结构是
的空间结构是___________ 。
(3)Ca元素位于元素周期表中的___________ 区,Ca的前三级电离能数据依次为 ,第三电离能增大较多的原因是
,第三电离能增大较多的原因是___________ 。
(4)硅与碳同族,键能:C-H___________ (填“大于”或“小于”) 。
。
(5)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到 的熔、沸点如下表所示
的熔、沸点如下表所示 :
:
20℃时,呈液态的是___________ (填化学式),熔、沸点依次升高的原因是___________ 。
(1)某同学所画基态镁原子的核外电子排布图为
 ,该电子排布图违背了
,该电子排布图违背了(2)
(3)Ca元素位于元素周期表中的
(4)硅与碳同族,键能:C-H
(5)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到
| 化合物 | ||||
| 熔点 | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点 | 187.2 | 330.8 | 427.2 | 560.7 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


