解答题-原理综合题 较难0.4 引用3 组卷758
Ⅰ.对温室气体二氧化碳的处理是化学工作者实现“碳中和”重点研究的课题,一种新的循环利用方案是用Bosch反应CO2(g) +2H2 (g)  C(s) +2H2O(g) △H。
C(s) +2H2O(g) △H。
(1)①已知:CO2(g)和H2O(g)的生成焓为- 394 kJ/mol 和- 242 kJ/mol, 则△H =_______ kJ/ mol,(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)。
②若要此反应自发进行,_______ ( 填“高温”或“低温” )更有利。
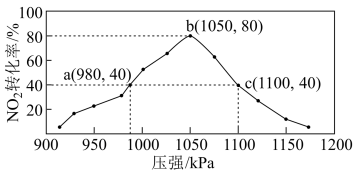
(2)NOx的含量是空气质量的一个重要指标,减少NOx的排放有利于保护环境。在密闭容器中加入4 mol NH3和3 mol NO2气体,发生反应:8NH3(g) +6NO2(g) 7N2(g) + 12H2O(g) △H <0,维持温度不变,不同压强下反应经过相同时间,NO2的转化率随着压强变化如图所示,下列说法错误的是_______。
7N2(g) + 12H2O(g) △H <0,维持温度不变,不同压强下反应经过相同时间,NO2的转化率随着压强变化如图所示,下列说法错误的是_______。
Ⅱ.活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s) +2NO2(g) N2(g) +2CO2(g) △H <0
N2(g) +2CO2(g) △H <0
(3)某实验室模拟该反应,在2L恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1℃,反应开始时压强为800kPa,平衡时容器内气体总压强增加30%,则用平衡分压代替其平衡浓度表示化学平衡常数Kp=_______ kPa [已知:气体分压(p分) =气体总压(p总)×体积分数]。
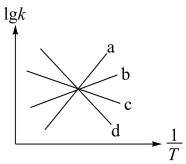
(4)已知该反应的正反应速率方程v正=k正·p2 (NO2),逆反应速率方程为v逆=k逆·p(N2) ·p2(CO2),其中k正、k逆分别为正逆反应速率常数,则如图( lgk表示速率常数的对数, 表示温度的倒数)所示a、b、c、d四条斜线中能表示lgk正随
表示温度的倒数)所示a、b、c、d四条斜线中能表示lgk正随 变化关系的斜线是
变化关系的斜线是_______ ,能表示lgk逆随 变化关系的斜线是
变化关系的斜线是_______ 。若将一定量的C(碳)和NO2投入到密闭容器中,保持温度T1℃、恒定在压强800 kPa发生该反应,则当NO2的转化率为40%时,v逆∶v正=_______ 。
(1)①已知:CO2(g)和H2O(g)的生成焓为- 394 kJ/mol 和- 242 kJ/mol, 则△H =
②若要此反应自发进行,
(2)NOx的含量是空气质量的一个重要指标,减少NOx的排放有利于保护环境。在密闭容器中加入4 mol NH3和3 mol NO2气体,发生反应:8NH3(g) +6NO2(g)

| A.反应速率:b点v正>a点v逆 |
| B.容器体积:Vc:Vb =8: 9 |
| C.在时间t内,若要提高NO2的转化率和反应速率,可以将H2O(g)液化分离 |
| D.维持压强980kPa更长时间,NO2的转化率大于40% |
Ⅱ.活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s) +2NO2(g)
(3)某实验室模拟该反应,在2L恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1℃,反应开始时压强为800kPa,平衡时容器内气体总压强增加30%,则用平衡分压代替其平衡浓度表示化学平衡常数Kp=
(4)已知该反应的正反应速率方程v正=k正·p2 (NO2),逆反应速率方程为v逆=k逆·p(N2) ·p2(CO2),其中k正、k逆分别为正逆反应速率常数,则如图( lgk表示速率常数的对数,

2022·安徽·模拟预测
类题推荐
对温室气体二氧化碳的处理是化学工作者实现“碳中和”重点研究的课题。
I.一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)⇌C(s)+2H2O(g) ΔH
(1)①已知:CO2(g)和H2O(g)的生成焓为-394kJ/mol和-242kJ/mol。则ΔH=___________ kJ/mol。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)。
②若要此反应自发进行,___________ (填“高温”或“低温”)更有利。
③Bosch反应必须在高温下才能启动,原因是___________ 。
(2)350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生Bosch反应。若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
①350℃时Bosch反应的Kp=___________ (Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。30min时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
II.二氧化碳也可用于尿素的制备:一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2,发生反应:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) ΔH<0
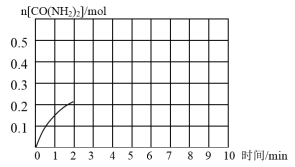
(3)该反应6min时达到平衡,测得容器中气体密度为5.4g·L-1。如图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到2min时,迅速将体系升温(仅发生上述反应),请在图中画出2~8min内容器中尿素的物质的量的变化趋势曲线__________ 。
I.一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)⇌C(s)+2H2O(g) ΔH
(1)①已知:CO2(g)和H2O(g)的生成焓为-394kJ/mol和-242kJ/mol。则ΔH=
②若要此反应自发进行,
③Bosch反应必须在高温下才能启动,原因是
(2)350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生Bosch反应。若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 6.00P | 5.60P | 5.30P | 5.15P | 5.06P | 5.00P | 5.00P |
①350℃时Bosch反应的Kp=
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。30min时,
II.二氧化碳也可用于尿素的制备:一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2,发生反应:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g) ΔH<0
(3)该反应6min时达到平衡,测得容器中气体密度为5.4g·L-1。如图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到2min时,迅速将体系升温(仅发生上述反应),请在图中画出2~8min内容器中尿素的物质的量的变化趋势曲线

为应对全球气候问题、建设资源节约型、环境友好型社会,对温室气体二氧化碳的处理是化学工作者实现减排重点研究的课题。
(1)处理方案反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。
将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应1,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
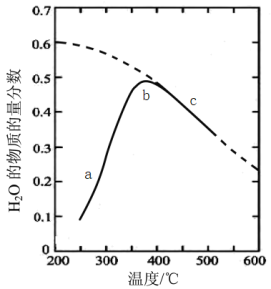
①请将a、b、c三点的逆反应速率va、vb、vc由大到小排序_______ 。
②在反应器中进行反应1,下列措施能提高CO2平衡转化率的是_______ (填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(2)一种新的处理方案是用反应2:CO2(g)+2H2(g)⇌C(s)+2H2O(g)∆H代替反应1。
I.①已知:CO2(g)和H2O(g)的生成焓为:-394kJ/mol,-242kJ/mol。则∆H=_______ kJ/mol。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热。)
②若要反应2自发进行,_______ (填“高温”或“低温”)更有利。
③反应2必须在高温下才能启动,原因是_______ 。
II.350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生反应2.若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如下表所示:
①350℃时反应2的Kp=_____ (Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
②反应2的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。30min时,
___ c2(H2O)/[c(CO2)·c2(H2)](填“>”“<”或“=”);
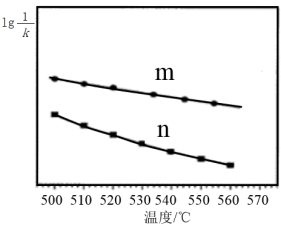
③反应2的lg 、lg
、lg 随温度变化的曲线如图所示,则
随温度变化的曲线如图所示,则___ (填“m”或“n”)表示lg 随温度变化的曲线。
随温度变化的曲线。
(1)处理方案反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)。
将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应1,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

①请将a、b、c三点的逆反应速率va、vb、vc由大到小排序
②在反应器中进行反应1,下列措施能提高CO2平衡转化率的是
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(2)一种新的处理方案是用反应2:CO2(g)+2H2(g)⇌C(s)+2H2O(g)∆H代替反应1。
I.①已知:CO2(g)和H2O(g)的生成焓为:-394kJ/mol,-242kJ/mol。则∆H=
②若要反应2自发进行,
③反应2必须在高温下才能启动,原因是
II.350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生反应2.若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如下表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 6.00P | 5.60P | 5.30P | 5.15P | 5.06P | 5.00P | 5.00P |
①350℃时反应2的Kp=
②反应2的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。30min时,
③反应2的lg

I.已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH1=-907kJ/mol;
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH2=-1269kJ/mol。
氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成两种无毒物质。
(1)写出该反应的热化学反应方程式:_______ 。该反应能在_______ (选项“高温”、“低温”或“任何温度”)下自发进行。
II.臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g) N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:

(2)温度为T1,0~25分钟NO2(g)的平均反应速率为_______ mol•L-1•min-1。
(3)该反应的ΔH_______ 0(填“大于”或“小于”)。
(4)下列措施能提高容器乙中NO2转化率的是_______ (填字母)。
(5)温度为T1时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2molO2,则脱硝反应达到平衡前,v(正)_______ v(逆)(填“>”“<”或“=”)。
III.活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(6)①某实验室模拟该反应,在恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1,反应开始时压强为800kPa,平衡时容器内气体总压强增加25%。则用平衡分压代替其平衡浓度表示化学平衡常数Kp=_______ kPa。[已知:气体分压(P分)=气体总E(P总)×体积分数]
②已知该反应的正反应速率方程v正=k正 p2(NO2),逆反应速率方程为v逆=k逆
p2(NO2),逆反应速率方程为v逆=k逆 p(N2)
p(N2)  p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=
p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=_______ 。(结果保留一位小数)
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH2=-1269kJ/mol。
氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成两种无毒物质。
(1)写出该反应的热化学反应方程式:
II.臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)
| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | 2molNO2、1molO3 | 2molNO2、1molO3 |

(2)温度为T1,0~25分钟NO2(g)的平均反应速率为
(3)该反应的ΔH
(4)下列措施能提高容器乙中NO2转化率的是
| A.向容器中充入He,增大容器的压强 |
| B.升高容器的温度 |
| C.向容器中再充入一定量的NO2 |
| D.向容器中再充入1molO3和2molNO2 |
III.活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s)+2NO2(g)
(6)①某实验室模拟该反应,在恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1,反应开始时压强为800kPa,平衡时容器内气体总压强增加25%。则用平衡分压代替其平衡浓度表示化学平衡常数Kp=
②已知该反应的正反应速率方程v正=k正
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


