解答题-原理综合题 较难0.4 引用2 组卷770
将二氧化碳转化为高附加值碳基燃料有利于实现人类活动的“碳中和”。
(1)已知:①CH4(g) +2O2(g)=CO2(g)+ 2H2O(g) ΔH1=-802 kJ·mol-1;
②2H2(g) +O2(g)=2H2O(g) ΔH2=-484 kJ·mol-1;
③CO2(g) +4H2(g) CH4(g) +2H2O(g) ΔH=a kJ·mol-1
CH4(g) +2H2O(g) ΔH=a kJ·mol-1
又知相关化学键的键能数据如下表所示。
则a=_______ ,使1molCH4裂解为相应的原子吸收_______ kJ的热量。
(2)在磷化硼(BP)催化下,按n(H2):n(CO2)=3:1的比例向某密闭容器中通入一定量的原料气可发生如下两个反应:
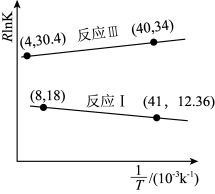
反应Ⅰ :CO2(g) +3H2(g) CH3OH (g)+ H2O(g) △H3
CH3OH (g)+ H2O(g) △H3
反应Ⅱ :CO2(g)+ H2(g) CO(g)+ H2O(g) △H4>0
CO(g)+ H2O(g) △H4>0
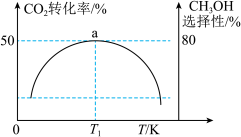
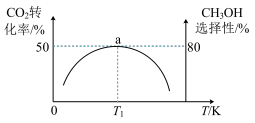
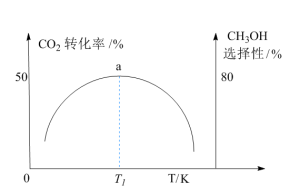
维持压强为6.4MPa,测得不同温度下,反应经过相同时间时CO2的转化率、甲醇的选择性如图1所示[CH3OH的选择性= ]。
]。
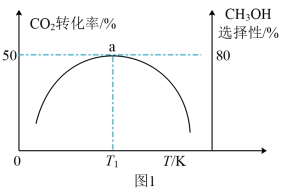
①△H3_______ 0(填“<”或“>”),判断的依据是_______ ,在实际工业生产中压强不能过高也不能过低的原因是_______ 。
②T1 K时,若反应从开始到达到a点所用时间为10 min,则v(CH3OH)=_______ MPa·min-1,反应Ⅰ的Kp=_______ (Kp指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=p总×A的物质的量分数,最终结果可用分数表示)。
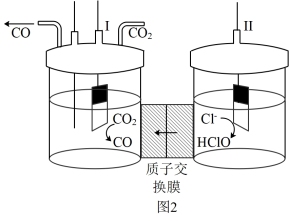
(3)以NaCl饱和溶液为电解质溶液,利用图2所示的装置将CO2转化为燃料CO。则电极Ⅱ接电源的_______ 极,阴极上电极反应式为_______ 。
(1)已知:①CH4(g) +2O2(g)=CO2(g)+ 2H2O(g) ΔH1=-802 kJ·mol-1;
②2H2(g) +O2(g)=2H2O(g) ΔH2=-484 kJ·mol-1;
③CO2(g) +4H2(g)
又知相关化学键的键能数据如下表所示。
| 化学键 | H-H | C=O | H-O | C- H |
| E/(kJ·mol-1) | 436 | 745 | 463 | x |
(2)在磷化硼(BP)催化下,按n(H2):n(CO2)=3:1的比例向某密闭容器中通入一定量的原料气可发生如下两个反应:
反应Ⅰ :CO2(g) +3H2(g)
反应Ⅱ :CO2(g)+ H2(g)
维持压强为6.4MPa,测得不同温度下,反应经过相同时间时CO2的转化率、甲醇的选择性如图1所示[CH3OH的选择性=

①△H3
②T1 K时,若反应从开始到达到a点所用时间为10 min,则v(CH3OH)=
(3)以NaCl饱和溶液为电解质溶液,利用图2所示的装置将CO2转化为燃料CO。则电极Ⅱ接电源的

2022·湖南·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网