解答题-实验探究题 适中0.65 引用2 组卷294
环己酮( )在工业上主要用作有机合成原料和溶剂。某实验小组选择价格低廉、污染更小的次氯酸钠-冰醋酸体系氧化环己醇(
)在工业上主要用作有机合成原料和溶剂。某实验小组选择价格低廉、污染更小的次氯酸钠-冰醋酸体系氧化环己醇( ) 的方法制备环己酮。
) 的方法制备环己酮。
(1)NaClO 溶液的制备
①工业上用氯气通入烧碱溶液的方法制备NaClO,请写出该反应的化学方程式___________ 。
②NaClO含量的测定:取①所得溶液(只含NaCl、NaClO、 NaOH) 20.00mL 于锥形瓶中,用0.1000mol/L NaNO2溶液进行滴定,达到滴定终点时,共消耗NaNO2溶液20.00mL。
已知:该反应可以用湿润的淀粉-KI试纸(白色)监控反应终点,且在此条件下NaNO2不氧化I-。
a.已知NaClO和NaNO2反应生成两种对环境友好的物质。由该实验测得NaClO溶液的物质的量浓度为___________ 。
b.滴定终点时,淀粉-KI试纸的颜色变化为___________ 。
(2)NaClO 氧化环己醇
反应原理:
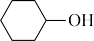 +NaClO
+NaClO
 +NaCl+H2O
+NaCl+H2O
已知:环己醇的相对分子质量为100;环己酮的相对分子质量为98。
步骤I:在装有冷凝管、温度计和滴液漏斗的三颈烧瓶中,加入7.5mL (7.0g)环己醇和4.0mL冰醋酸。在滴液漏斗中加入100.0mLNaClO水溶液,分四次加入三颈烧瓶中,边加边振荡,保持反应温度为40°C-45°C.加完后,放置20分钟,并搅拌。
步骤II:用淀粉- KI试纸检验NaClO是否过量,若过量则加入适量饱和Na2SO3溶液除去NaClO。随后再加入适量NaOH溶液,边加边振荡。
步骤III:将步骤II得到的反应液进行蒸馏,得到40.0mL馏出液,再在馏出液中加入5.0g固体氯化钠,振荡使之大部分溶解。将馏出液转入分液漏斗分离出有机层,用无水硫酸镁干燥后蒸馏,收集到产品4.116g。
请回答下列问题:
①在反应装置中应选用___________ 冷凝管(填“直形”或“球形”)。
②实验温度要保持40°C -45°C,最好选择的加热方式是___________ ; 不能低于40°C的原因是___________ 。
③加入饱和Na2SO3溶液时发生的离子反应方程式是_______ 。;随后加入适量NaOH溶液的目的是_______ 。
④本实验所得到的环己酮的产率是___________ 。
⑤本实验最有可能产生的有毒气体是___________ , 所以要在通风橱中进行实验。
 )在工业上主要用作有机合成原料和溶剂。某实验小组选择价格低廉、污染更小的次氯酸钠-冰醋酸体系氧化环己醇(
)在工业上主要用作有机合成原料和溶剂。某实验小组选择价格低廉、污染更小的次氯酸钠-冰醋酸体系氧化环己醇( ) 的方法制备环己酮。
) 的方法制备环己酮。(1)NaClO 溶液的制备
①工业上用氯气通入烧碱溶液的方法制备NaClO,请写出该反应的化学方程式
②NaClO含量的测定:取①所得溶液(只含NaCl、NaClO、 NaOH) 20.00mL 于锥形瓶中,用0.1000mol/L NaNO2溶液进行滴定,达到滴定终点时,共消耗NaNO2溶液20.00mL。
已知:该反应可以用湿润的淀粉-KI试纸(白色)监控反应终点,且在此条件下NaNO2不氧化I-。
a.已知NaClO和NaNO2反应生成两种对环境友好的物质。由该实验测得NaClO溶液的物质的量浓度为
b.滴定终点时,淀粉-KI试纸的颜色变化为
(2)NaClO 氧化环己醇
反应原理:
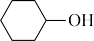 +NaClO
+NaClO +NaCl+H2O
+NaCl+H2O已知:环己醇的相对分子质量为100;环己酮的相对分子质量为98。
步骤I:在装有冷凝管、温度计和滴液漏斗的三颈烧瓶中,加入7.5mL (7.0g)环己醇和4.0mL冰醋酸。在滴液漏斗中加入100.0mLNaClO水溶液,分四次加入三颈烧瓶中,边加边振荡,保持反应温度为40°C-45°C.加完后,放置20分钟,并搅拌。
步骤II:用淀粉- KI试纸检验NaClO是否过量,若过量则加入适量饱和Na2SO3溶液除去NaClO。随后再加入适量NaOH溶液,边加边振荡。
步骤III:将步骤II得到的反应液进行蒸馏,得到40.0mL馏出液,再在馏出液中加入5.0g固体氯化钠,振荡使之大部分溶解。将馏出液转入分液漏斗分离出有机层,用无水硫酸镁干燥后蒸馏,收集到产品4.116g。
请回答下列问题:
①在反应装置中应选用
②实验温度要保持40°C -45°C,最好选择的加热方式是
③加入饱和Na2SO3溶液时发生的离子反应方程式是
④本实验所得到的环己酮的产率是
⑤本实验最有可能产生的有毒气体是
2022·四川雅安·三模
类题推荐
对氯甲苯是生产农药、医药染料的重要中间体,实验室常用对甲基苯胺和亚硝酸钠在冷的无机酸溶液中生成重氮盐,制得的重氮盐再进一步取代即可制得对氯甲苯,其反应原理如下:
实验步骤:
(一)重氮盐溶液的制备
在烧杯中依次加入15 mL水、15 mL浓盐酸、5.35 g对甲基苯胺,加热至固体充分溶解,将溶液置于冰盐浴中,用玻璃棒不断搅拌至糊状,在0 ℃条件下边搅拌边滴入80% 溶液,用淀粉-KI试纸检验混合液,若试纸变蓝则不必再加
溶液,用淀粉-KI试纸检验混合液,若试纸变蓝则不必再加 溶液。
溶液。
(二)对氯甲苯的制备
将制好的对甲基苯胺重氮盐滴加至装有冷的CuCl-HCl溶液的烧瓶中,滴加完毕后,室温放置30 min,有大量气体X逸出,在55 ℃水浴中使气体X释放完全,向烧瓶A中加入适量蒸馏水,进行水蒸气蒸馏,当不再有油滴馏出时停止加热。将馏出液转移至分液漏斗,分离出有机层(粗产品),用环己烷萃取水层两次,将萃取所得有机层与粗产品合并,分别用10% NaOH溶液、水、浓硫酸、水洗涤,再用无水 干燥后蒸馏,控制温度在158~162 ℃收得馏分3.8 g。
干燥后蒸馏,控制温度在158~162 ℃收得馏分3.8 g。
(1)制备重氮盐溶液时,用淀粉-KI试纸检验混合液,试纸变蓝且产生无色气体,该气体遇空气变红棕色,导致试纸变蓝的反应的化学方程式为___________ 。
(2)仪器C的名称为___________ ,A中玻璃管的作用为___________ 。
(3)用环己烷萃取水层时,所得有机层从分液漏斗___________ (填“上口”或“下口”)放出,将萃取所得有机层与粗产品合并的目的是___________ 。
(4)粗产品经干燥后,先用___________ (填序号)蒸馏由低沸点杂质,再控制温度在158~162 ℃改用___________ (填序号)收集馏分。
A.直形冷凝管 B.球形冷凝管 C.空气冷凝管
(5)对氯甲苯的产率为___________ (保留两位有效数字)。
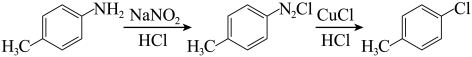
| 物质 | 相对分子质量 | 密度 | 沸点/℃ | 溶解度 |
| 对甲基苯胺 | 107 | 0.97 | 197.4 | 微溶于水 |
| 环己烷 | 84 | 0.78 | 80.7 | 难溶于水 |
| 对氯甲苯 | 126.5 | 1.07 | 159.2 | 难溶于水,易溶于乙醚、环己烷等有机溶剂 |
(一)重氮盐溶液的制备
在烧杯中依次加入15 mL水、15 mL浓盐酸、5.35 g对甲基苯胺,加热至固体充分溶解,将溶液置于冰盐浴中,用玻璃棒不断搅拌至糊状,在0 ℃条件下边搅拌边滴入80%
(二)对氯甲苯的制备
将制好的对甲基苯胺重氮盐滴加至装有冷的CuCl-HCl溶液的烧瓶中,滴加完毕后,室温放置30 min,有大量气体X逸出,在55 ℃水浴中使气体X释放完全,向烧瓶A中加入适量蒸馏水,进行水蒸气蒸馏,当不再有油滴馏出时停止加热。将馏出液转移至分液漏斗,分离出有机层(粗产品),用环己烷萃取水层两次,将萃取所得有机层与粗产品合并,分别用10% NaOH溶液、水、浓硫酸、水洗涤,再用无水
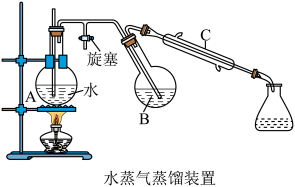
(1)制备重氮盐溶液时,用淀粉-KI试纸检验混合液,试纸变蓝且产生无色气体,该气体遇空气变红棕色,导致试纸变蓝的反应的化学方程式为
(2)仪器C的名称为
(3)用环己烷萃取水层时,所得有机层从分液漏斗
(4)粗产品经干燥后,先用
A.直形冷凝管 B.球形冷凝管 C.空气冷凝管
(5)对氯甲苯的产率为
实验室可用环己醇制备环己酮,反应原理和实验装置(部分夹持装置略)如图:
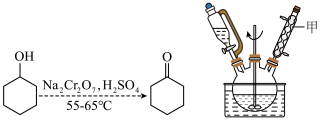
已知:环己醇、环己酮的部分物理性质如表(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)。
I.制备:实验中通过恒压滴液漏斗将酸性Na2Cr2O7溶液加到盛有8.4mL(0.08mol环己醇的三颈烧瓶中,保持反应温度在55-65℃之间继续搅拌20min后,加入1.0g草酸,反应液变为墨绿色。
(1)仪器甲的名称是______ 。
(2)酸性Na2Cr2O7溶液氧化环己醇反应放热,则滴加酸性Na2Cr2O7溶液的方式为______ 。
(3)为控制反应体系温度在55-65℃范围内,可采取的加热方式是______ 。
(4)上述步骤中,加入草酸的目的是______ 。
Ⅱ.分离提纯:环己酮的提纯需要经过以下操作:

a.向反应后的混合液中加入NaCl固体至饱和,静置,分液;
b.水层用乙醚(乙醚沸点34.6℃)萃取,萃取液并入有机层;
c.有机层中加入无水MgSO4固体,除去少量的水,过滤;
d.将滤液在50-55℃蒸馏除去乙醚:
e.再用如图所示装置蒸馏,收集151-156℃馏分。
(5)①操作b中水层用乙醚萃取的目的是______ 。
②如果不经操作c,直接蒸馏不能分离环己酮和水的原因是______ 。
③操作e中蒸馏收集环己酮产品时,不用水冷凝,而用空气冷凝管的原因是______ 。
(6)最终得到纯产品4.9mL,则环已酮的产率为______ (计算结果精确到0.1%)。

已知:环己醇、环己酮的部分物理性质如表(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)。
| 物质 | 沸点/℃ | 密度/g•cm-3•20℃ | 溶解性 | 相对分子质量 |
| 环己醇 | 161.1(97.8) | 0.96 | 能溶于水和醚 | 100 |
| 环己酮 | 155.6(95.0) | 0.95 | 微溶于水,能溶于醚 | 98 |
(1)仪器甲的名称是
(2)酸性Na2Cr2O7溶液氧化环己醇反应放热,则滴加酸性Na2Cr2O7溶液的方式为
(3)为控制反应体系温度在55-65℃范围内,可采取的加热方式是
(4)上述步骤中,加入草酸的目的是
Ⅱ.分离提纯:环己酮的提纯需要经过以下操作:

a.向反应后的混合液中加入NaCl固体至饱和,静置,分液;
b.水层用乙醚(乙醚沸点34.6℃)萃取,萃取液并入有机层;
c.有机层中加入无水MgSO4固体,除去少量的水,过滤;
d.将滤液在50-55℃蒸馏除去乙醚:
e.再用如图所示装置蒸馏,收集151-156℃馏分。
(5)①操作b中水层用乙醚萃取的目的是
②如果不经操作c,直接蒸馏不能分离环己酮和水的原因是
③操作e中蒸馏收集环己酮产品时,不用水冷凝,而用空气冷凝管的原因是
(6)最终得到纯产品4.9mL,则环已酮的产率为
环己酮是一种重要的有机化合物,常温下为无色透明液体,带有泥土气息。实验室制备环己酮的装置示意图以及各物质性质如图所示:
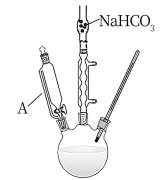
合成步骤:
1.在三口烧瓶中加入5.2mL环己醇,12.5mL乙酸。并在仪器A中加入60~70mL次氯酸钠溶液。安装反应装置。
2.滴加适量次氯酸钠溶液,维持反应温度在30~35℃,搅拌5~10min。
3.再逐滴加入次氯酸钠溶液,直至反应液使淀粉KI试纸变蓝,在室温下继续搅拌一段时间。
4.滴加饱和亚硫酸氢钠溶液直至反应液不能使淀粉KI试纸显蓝色。
收集步骤:向反应液中加入25mL水和几粒沸石,加热蒸馏,收集馏分。在搅拌下向馏出液分批加入无水碳酸钠至无气体产生。加入氯化钠使之变成饱和溶液,充分搅拌。将反应混合液倒入分液漏斗,分出有机层并用无水硫酸镁干燥。
已知:1.Ka(CH3COOH)=18×10-5,Ka1(H2CO3)=4.5×10-7,Ka(HClO)=3×10-8。
2.HClO的氧化性强于NaClO。
回答下列问题:
(1)仪器A的名称是___ 。
(2)加入乙酸的目的是___ 。
(3)反应维持30~35℃的原因是___ 。
(4)加热蒸馏时,收集馏分的温度应是___ 。
A.161℃ B.118℃ C.155℃
(5)滴加饱和亚硫酸氢钠溶液所发生的反应的离子方程式___ 。
(6)实验室合成环已酮的化学反应方程式是___ 。
(7)无水硫酸镁干燥后为得到纯净环己酮,还应进行的操作为___ 。
(8)若得到3.7mL环己酮,则产率为___ (保留两位有效数字)。

| 名称 | 沸点(℃) | 溶解度(水)(g/100mL) | 密度)(g/mL) |
| 乙酸 | 118 | 互溶 | 1.05 |
| 环己醇 | 161 | 5.67 | 1.0 |
| 环已酮 | 155 | 2.4 | 0.95 |
1.在三口烧瓶中加入5.2mL环己醇,12.5mL乙酸。并在仪器A中加入60~70mL次氯酸钠溶液。安装反应装置。
2.滴加适量次氯酸钠溶液,维持反应温度在30~35℃,搅拌5~10min。
3.再逐滴加入次氯酸钠溶液,直至反应液使淀粉KI试纸变蓝,在室温下继续搅拌一段时间。
4.滴加饱和亚硫酸氢钠溶液直至反应液不能使淀粉KI试纸显蓝色。
收集步骤:向反应液中加入25mL水和几粒沸石,加热蒸馏,收集馏分。在搅拌下向馏出液分批加入无水碳酸钠至无气体产生。加入氯化钠使之变成饱和溶液,充分搅拌。将反应混合液倒入分液漏斗,分出有机层并用无水硫酸镁干燥。
已知:1.Ka(CH3COOH)=18×10-5,Ka1(H2CO3)=4.5×10-7,Ka(HClO)=3×10-8。
2.HClO的氧化性强于NaClO。
回答下列问题:
(1)仪器A的名称是
(2)加入乙酸的目的是
(3)反应维持30~35℃的原因是
(4)加热蒸馏时,收集馏分的温度应是
A.161℃ B.118℃ C.155℃
(5)滴加饱和亚硫酸氢钠溶液所发生的反应的离子方程式
(6)实验室合成环已酮的化学反应方程式是
(7)无水硫酸镁干燥后为得到纯净环己酮,还应进行的操作为
(8)若得到3.7mL环己酮,则产率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


