解答题-工业流程题 较难0.4 引用2 组卷505
无水氯化钴( )呈蓝色,吸收不同量的水后变为粉红色至红色(如
)呈蓝色,吸收不同量的水后变为粉红色至红色(如 呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、
呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、 ,含少量Ni、
,含少量Ni、 等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
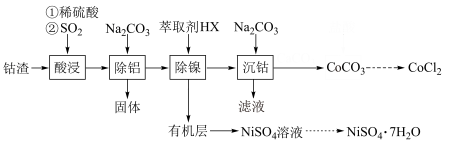
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
② 极易水解生成两种气体,其中一种气体能使品红溶液褪色。
极易水解生成两种气体,其中一种气体能使品红溶液褪色。
回答下列问题:
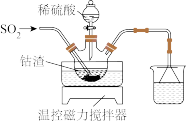
(1)酸浸。将一定量钴渣加入到三颈瓶中(装置如图所示),将稀硫酸通过滴液漏斗加入其中,再向悬浊液中通入 。写出
。写出 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(2)除铝。得到固体的主要成分是_______ (填化学式),该步调节pH的范围为_______ 。
(3)制备无水 。实验室由
。实验室由 制备无水
制备无水 ,请补充实验方案:①
,请补充实验方案:①_______ ,用蒸馏水洗涤2~3次,低温干燥。将所得固体( )置于圆底烧瓶中,②
)置于圆底烧瓶中,②_______ ,停止加热,得到无水 。(实验中须使用的试剂:
。(实验中须使用的试剂: 、
、 盐酸、
盐酸、 NaOH溶液)。
NaOH溶液)。
(4)钴(Ⅲ)可形成 (
( ,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L
,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L  溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为
溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为_______ (写出计算过程)。

已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
| 金属离子 | |||
| 升始沉淀的pH | 4.0 | 7.6 | 7.7 |
| 完全沉淀的pH | 5.2 | 9.2 | 9.5 |
回答下列问题:
(1)酸浸。将一定量钴渣加入到三颈瓶中(装置如图所示),将稀硫酸通过滴液漏斗加入其中,再向悬浊液中通入

(2)除铝。得到固体的主要成分是
(3)制备无水
(4)钴(Ⅲ)可形成
21-22高三下·江苏南京·阶段练习
类题推荐
CoCl2常作湿度指示剂、分析试剂等。以钻液(主要成分是CoO、Co2O3,含少量Ni、Al2O3等杂质)为原料制备无水氯化钴(CoCl2)的流程如图(部分产物和条件省略):
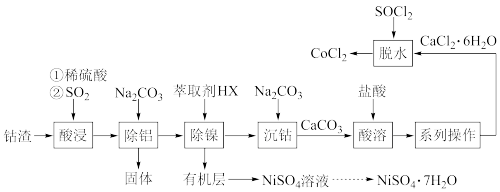
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
②SOCl2易水解生成内种气体,其中一种气体能使品红溶液褪色。
回答下列问题:
(1)“酸浸”中SO2的作用是____ ,其发生的相关反应的离子方程式为____ 。
(2)“除铝”得到固体的主要成分是___ (填化学式),该步调节pH的范围为____ 。
(3)“除镍”中分离有机层的操作若在实验室中进行,需要使用的玻璃仪器有烧杯和___ (填名称)。
(4)“系列操作”包括____ 、冷却结晶、过滤、洗涤等。
(5)在加热条件下“脱水”,写出该过程中总反应的化学方程式:___ 。

已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
| 金属于 | Al3+ | Co2+ | Ni2+ |
| 升始沉淀的pH | 4.0 | 7.6 | 7.7 |
| 完全沉淀的pH | 5.2 | 9.2 | 9.5 |
回答下列问题:
(1)“酸浸”中SO2的作用是
(2)“除铝”得到固体的主要成分是
(3)“除镍”中分离有机层的操作若在实验室中进行,需要使用的玻璃仪器有烧杯和
(4)“系列操作”包括
(5)在加热条件下“脱水”,写出该过程中总反应的化学方程式:
CoCl2常作湿度指示剂、分析试剂等。以钴渣(主要成分是CoO、Co2O3,含少量Ni、SiO2、Al2O3等杂质)为原料制备无水氯化钴(CoCl2)的流程如图(部分产物和条件省略):
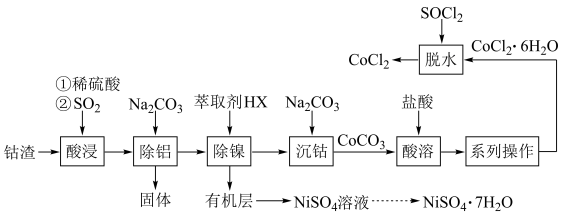
已知:① 几种金属离子转化为氢氧化物沉淀的pH如表所示:
② SOCl2易水解生成两种气体,其中一种气体能使品红溶液褪色。
回答下列问题:
(1)“酸浸”中提高反应速率的措施是_________________________ (答一点即可);SO2的作用是________________ ,其发生反应的离子方程式为________________ 。
(2)“除铝”得到固体的主要成分是______ (填化学式),该步调节pH的范围为_______ 。
(3)“除镍”中分离有机层的操作若在实验室中进行,需要使用的玻璃仪器为______ (填名称)。
(4)“系列操作”包括__________ 、_________ 、过滤、洗涤等。
(5)在加热条件下“脱水”,写出该过程中总反应的化学方程式:____________________ 。

已知:① 几种金属离子转化为氢氧化物沉淀的pH如表所示:
金属离子 | Al3+ | Co2+ | Ni2+ |
开始沉淀的pH | 4.0 | 7.6 | 7.7 |
完全沉淀的pH | 5.2 | 9.2 | 9.5 |
回答下列问题:
(1)“酸浸”中提高反应速率的措施是
(2)“除铝”得到固体的主要成分是
(3)“除镍”中分离有机层的操作若在实验室中进行,需要使用的玻璃仪器为
(4)“系列操作”包括
(5)在加热条件下“脱水”,写出该过程中总反应的化学方程式:
钴的氧化物常用于制取催化剂和颜料等。以钴渣(要成分是CoO、Co2O3、含少量Ni、Al2O3等杂质)为原料可支取钴的氧化物的流程如图(部分产物和条件省略)。

已知:①Co2+和Co3+均易与NH3形成配合物;
②氧化性:Co2O3>O2>Cl2;
③部分金属离子沉淀的pH如下表(开始沉淀的pH按离子浓度为1.00mol/L计算):
回答下列问题:
(1)酸浸:将稀硫酸加入到一定量的钴渣中,再向悬浊液中通入SO2,写出Co2O3发生反应的离子方程式___________ 。
(2)除铝:得到固体的主要成分是___________ 。(填化学式)
(3)除镍:向除铝的滤液中,加入某有机萃取剂(HX),通过萃取、反萃取可以除去Ni2+,并且得到NiSO4溶液。已知Ni2+被萃取原理可表示为:Ni2+(水层)+2HA(有机层) Ni(A)2(有机层)+2H+(水层),反萃取的目的是将有机相Ni2+转移到水层。使Ni2+尽可能多地发生上述转移,简述反萃取的实验操作
Ni(A)2(有机层)+2H+(水层),反萃取的目的是将有机相Ni2+转移到水层。使Ni2+尽可能多地发生上述转移,简述反萃取的实验操作___________ 。
(4)沉钻:向除杂后的溶液中加入NaHCO3溶液,水浴加热至50°C左右,反应生成CoCO3沉淀。若改用NH4HCO3作沉淀剂,CoCO3的沉淀率明显降低,原因是___________ 。
(5)热分解:在纯氧中加热分解CoCO3,测得加热升温过程中固体的质量变化如图所示。加热分解CoCO3制备CoO需要控制的温度为___________ (写出计算推理过程)。

(6)从环保角度考虑,以含钴废料(主要成分为CO2O3,含少量Fe2O3、Al2O3)先制备CoCO3,再进一步制备CoO的实验方案为___________ 。(可选试剂:1.000molL-1H2O2溶液,l.000molL-1HCl,l.000molL-1H2SO4,溶液,0.1000molL-1NaOH溶液,1.000molL-1NaHCO3溶液)

已知:①Co2+和Co3+均易与NH3形成配合物;
②氧化性:Co2O3>O2>Cl2;
③部分金属离子沉淀的pH如下表(开始沉淀的pH按离子浓度为1.00mol/L计算):
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Co2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 3.0 | 6.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 5.0 | 9.2 |
(1)酸浸:将稀硫酸加入到一定量的钴渣中,再向悬浊液中通入SO2,写出Co2O3发生反应的离子方程式
(2)除铝:得到固体的主要成分是
(3)除镍:向除铝的滤液中,加入某有机萃取剂(HX),通过萃取、反萃取可以除去Ni2+,并且得到NiSO4溶液。已知Ni2+被萃取原理可表示为:Ni2+(水层)+2HA(有机层)
(4)沉钻:向除杂后的溶液中加入NaHCO3溶液,水浴加热至50°C左右,反应生成CoCO3沉淀。若改用NH4HCO3作沉淀剂,CoCO3的沉淀率明显降低,原因是
(5)热分解:在纯氧中加热分解CoCO3,测得加热升温过程中固体的质量变化如图所示。加热分解CoCO3制备CoO需要控制的温度为

(6)从环保角度考虑,以含钴废料(主要成分为CO2O3,含少量Fe2O3、Al2O3)先制备CoCO3,再进一步制备CoO的实验方案为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


