解答题-原理综合题 适中0.65 引用3 组卷573
研究烟气的脱硝(除NOx)、脱硫(除SO2)技术有着积极的环保意义。
(1)一定条件下,用CH4催化还原可消除NO污染。
已知: Ⅰ.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -865.0 kJ ·mol-1
Ⅱ.2NO(g)+O2(g)=2NO2(g) △H= -112.5 kJ·mol-1
Ⅲ.适量的N2和O2完全反应,每生成2.24 L(标准状况下)NO时,吸收8.9 kJ的热量;
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=____ kJ·mol-1。
(2)一定条件下,用NH3催化还原可消除NO污染,其反应原理如下:4NH3 (g)+6NO(g) 5N2(g)+6H2O(g) △H= - 1980 kJ/mol
5N2(g)+6H2O(g) △H= - 1980 kJ/mol
①应速率与浓度之间存在如下关系:v正=k正c4(NH3)·c6 (NO),v逆=k逆c5(N2)·c 6(H2O)。k正、k 逆为速率常数,只受温度影响。350°C时,在2 L恒容密闭容器中,通入0.9 mol NH3(g)和1.2 mol NO(g)发生反应,平衡时NO转化率为50%,则此温度下 =
=____ 。
②若保持其他条件不变,将上述恒温恒容容器改为恒温恒压容器,达到新平衡时,N2的体积分数与原平衡相比将____ (填“增大”、 “减小”或“不变”);若温度升高,则k正增大m倍,k逆增大n倍,则m____ n(填“>” “<”或“=”)。
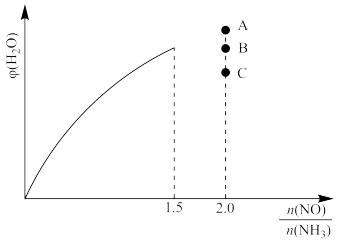
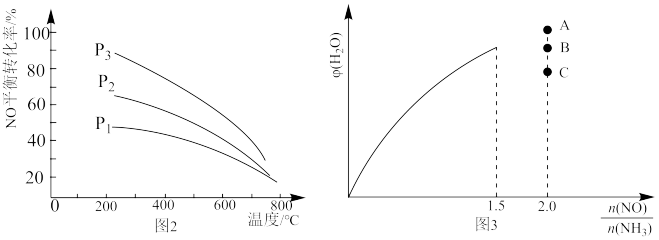
③保持温度不变,在恒容密闭容器中按一定比例充入NH3(g)和NO(g)发生反应,达到平衡时,H2O(g)的体积分数φ(H2O)随 的变化如图所示,当
的变化如图所示,当 =2.0时, 达到平衡φ (H2O)可能是 A、B、C三点中的
=2.0时, 达到平衡φ (H2O)可能是 A、B、C三点中的____ (填“A”、“B”或“C”)。
(3)利用电解装置也可进行烟气处理,如图可将雾霾中的NO、SO2分别转化为 和
和 ,阳极的电极反应式为
,阳极的电极反应式为___________ ;物质A是___________ (填化学式)。

(1)一定条件下,用CH4催化还原可消除NO污染。
已知: Ⅰ.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -865.0 kJ ·mol-1
Ⅱ.2NO(g)+O2(g)=2NO2(g) △H= -112.5 kJ·mol-1
Ⅲ.适量的N2和O2完全反应,每生成2.24 L(标准状况下)NO时,吸收8.9 kJ的热量;
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=
(2)一定条件下,用NH3催化还原可消除NO污染,其反应原理如下:4NH3 (g)+6NO(g)
①应速率与浓度之间存在如下关系:v正=k正c4(NH3)·c6 (NO),v逆=k逆c5(N2)·c 6(H2O)。k正、k 逆为速率常数,只受温度影响。350°C时,在2 L恒容密闭容器中,通入0.9 mol NH3(g)和1.2 mol NO(g)发生反应,平衡时NO转化率为50%,则此温度下
②若保持其他条件不变,将上述恒温恒容容器改为恒温恒压容器,达到新平衡时,N2的体积分数与原平衡相比将
③保持温度不变,在恒容密闭容器中按一定比例充入NH3(g)和NO(g)发生反应,达到平衡时,H2O(g)的体积分数φ(H2O)随

(3)利用电解装置也可进行烟气处理,如图可将雾霾中的NO、SO2分别转化为

2022·吉林长春·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

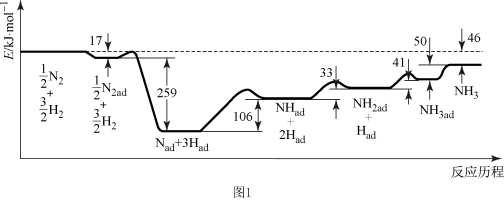
 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是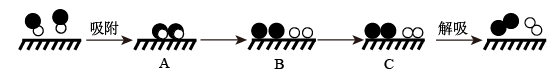
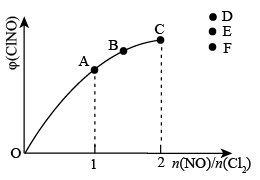
 2 ClNO(g)
2 ClNO(g)