解答题-原理综合题 适中0.65 引用2 组卷412
Ⅰ.
已知反应:
①
②
③
(1)
写出该过程的热化学方程式
(2)为提高丙烷与
a.恒容时充入惰性气体 b.增大
(3)在一定温度下,向恒容密闭容器中充入一定量的
(4)
Ⅱ.
已知反应:④
⑤
(5)不同条件下,相同的时间段内
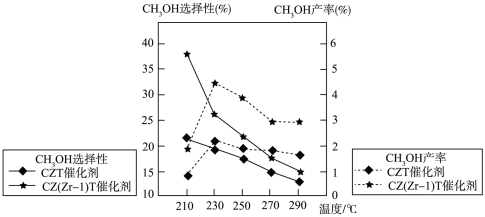
①由图可知,合成甲醇的适宜条件为
A.CZT催化剂 B.CZ(Zr-1)T催化剂 C.230℃ D.290℃
②在230℃以上,升高温度,
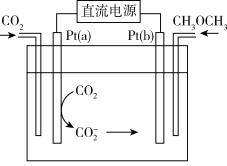
Ⅲ.利用电催化可将
(6)其中铜电极上产生HCOOH的电极反应式为
2022·湖南长沙·模拟预测
类题推荐
为实现“碳达峰”、“碳中和”目标,可将CO2催化加氢制甲醇。该反应体系中涉及以下两个主要反应:
反应I: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49kJ/mol
CH3OH(g)+H2O(g) ΔH1=-49kJ/mol
反应II: CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41kJ/mol
CO(g)+H2O(g) ΔH2=+41kJ/mol
(1)反应CO(g)+2H2(g) CH3OH(g)的反应热ΔH3=
CH3OH(g)的反应热ΔH3=_______ 。
(2)在密闭容器中,上述反应混合体系建立平衡后,下列说法正确的是_______。
(3)不同条件下,相同的时间段内CH3OH的选择性和产率随温度的变化如图。

CH3OH的选择性= 100%
100%
①由图可知,合成甲醇的适宜条件为_______ (填标号)
A.CZT催化剂 B. CZ(Zr-1)T 催化剂 C.230°C D.290 °C
②在230°C以上,升高温度,CO2的平衡转化率增大,但甲醇的产率降低,原因是_______ 。
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,发生反应I和反应II,反应达平衡时,CO2的转化率为50%,气体体积减小10%,则在达到平衡时, CH3OH的选择性=_______ ,反应II的平衡常数K=_______ 。
(5)利用电催化可将CO2同时转化为多种燃料,装置如图:
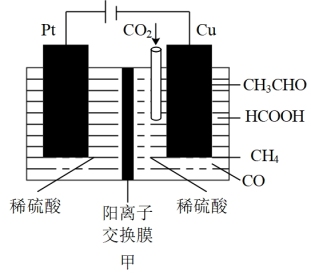
①铜电极上产生HCOOH的电极反应式为_______ 。
②若铜电极上只生成5.6gCO,则铜极区溶液质量变化了_______ g。
反应I: CO2(g)+3H2(g)
反应II: CO2(g)+H2(g)
(1)反应CO(g)+2H2(g)
(2)在密闭容器中,上述反应混合体系建立平衡后,下列说法正确的是_______。
| A.增大压强,CO的浓度一定保持不变 |
| B.降低温度,反应II的逆反应速率增大,正反应速率减小 |
| C.增大CH3OH的浓度,反应II的平衡向正反应方向移动 |
| D.恒温恒容下充入氦气,反应I的平衡向正反应方向移动 |

CH3OH的选择性=
①由图可知,合成甲醇的适宜条件为
A.CZT催化剂 B. CZ(Zr-1)T 催化剂 C.230°C D.290 °C
②在230°C以上,升高温度,CO2的平衡转化率增大,但甲醇的产率降低,原因是
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,发生反应I和反应II,反应达平衡时,CO2的转化率为50%,气体体积减小10%,则在达到平衡时, CH3OH的选择性=
(5)利用电催化可将CO2同时转化为多种燃料,装置如图:

①铜电极上产生HCOOH的电极反应式为
②若铜电极上只生成5.6gCO,则铜极区溶液质量变化了
我国科学家在含铂高效催化剂作用下把二氧化碳高效转化为清洁液态燃料—甲醇,反应原理为 。回答下列问题:
。回答下列问题:
(1)已知:①
②
③
则 的反应热
的反应热
_______  。
。
(2)在绝热恒容的密闭容器中进行反应 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是_______(填标号)。
时刻达到平衡状态的是_______(填标号)。
(3)在恒温恒容的密闭容器中进行反应 ,下列有利于提高
,下列有利于提高 的平衡转化率的措施有_______(填标号)。
的平衡转化率的措施有_______(填标号)。
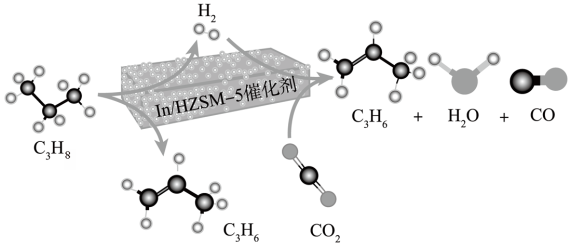
(4)恒压下将 和
和 按体积比1:3混合,在不同催化剂作用下发生如下反应:
按体积比1:3混合,在不同催化剂作用下发生如下反应:
反应Ⅰ:
反应Ⅱ:
在相同的时间段内 的选择性和产率随温度的变化如图所示,其中
的选择性和产率随温度的变化如图所示,其中 的选择性=
的选择性= 。
。 产率随温度升高而下降的原因是
产率随温度升高而下降的原因是_______ 。
②在上述条件下合成甲醇的工业条件是_______ (填标号)。
A.CZ(Zr-1)T催化剂 B.210℃ C.230℃ D.CZT催化剂
(5)一定条件下,将2mol 和4mol
和4mol 充入密闭容器中,发生反应
充入密闭容器中,发生反应 。
。 的平衡转化率与温度、平衡总压强的关系如图所示。
的平衡转化率与温度、平衡总压强的关系如图所示。 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ 。
②255℃时,该反应的压强平衡常数
_______  (
( 为以分压表示的平衡常数,分压=总压×物质的量分数。计算结果保留1位小数)。
为以分压表示的平衡常数,分压=总压×物质的量分数。计算结果保留1位小数)。
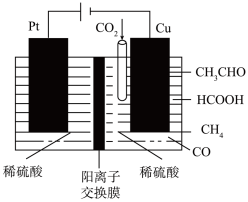
(6)利用 电池(工作原理如图所示)能有效地将
电池(工作原理如图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝 。电池的正极反应式为
。电池的正极反应式为 。正极反应过程中,
。正极反应过程中, 是催化剂,催化过程可表示为:①
是催化剂,催化过程可表示为:① ,②……。
,②……。_______ 。
(1)已知:①
②
③
则
(2)在绝热恒容的密闭容器中进行反应
A.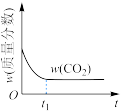 | B.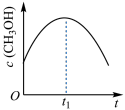 |
C.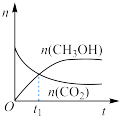 | D.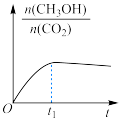 |
(3)在恒温恒容的密闭容器中进行反应
| A.使用更加高效的催化剂 | B.充入少量氦气(He) |
| C.减小起始投料比 | D.将水蒸气及时分离出来 |
(4)恒压下将
反应Ⅰ:
反应Ⅱ:
在相同的时间段内
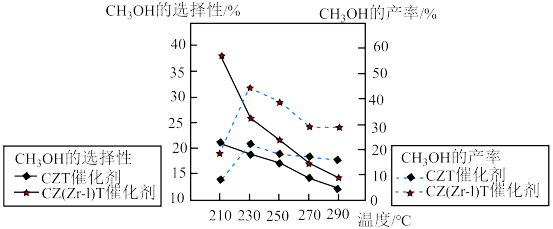
②在上述条件下合成甲醇的工业条件是
A.CZ(Zr-1)T催化剂 B.210℃ C.230℃ D.CZT催化剂
(5)一定条件下,将2mol
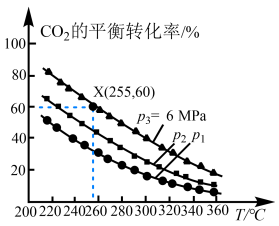
②255℃时,该反应的压强平衡常数
(6)利用

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
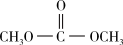 )的电化学方法,a极连接直流电源的
)的电化学方法,a极连接直流电源的