解答题-原理综合题 适中0.65 引用3 组卷285
氮的氧化物是大气污染物之一。研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H1=-907kJ∙mol-1;
②①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ∆H2=-1269.0kJ∙mol-1。
若4NH3(g)+6NO(g)=5N2(g)+6H2O(g)的逆反应活化能为E逆=akJ∙mol-1,则其正反应活化能为_______ kJ∙mol-1(用含a的代数式表示)。
(2)氢气选择性催化还原NO是一种比NH3还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如下图:

①Pt原子表面上发生的反应除N+N=N2、2H+O=H2O外还有_____ 。
②已知在HY载体表面发生反应的NO、O2物质的量之比为1∶1,补充并配平下列离子方程式:_______ 。
 +NO+O2→N2+H2O+_______
+NO+O2→N2+H2O+_______
(3)硫碘循环(SI循环)是目前最有前景和研究最多的一个热化学循环。SI循环涉及如下两个反应:
反应I(Bunsen反应):SO2(g)+I2(s)+2H2O(l)⇌2HI(aq)+H2SO4(aq) ∆H1=akJ∙mol-1
反应II:2HI(aq)⇌H2(g)+I2(s) ∆H2=bkJ∙mol-1
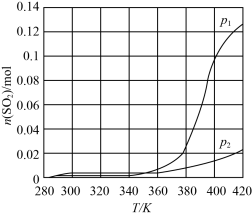
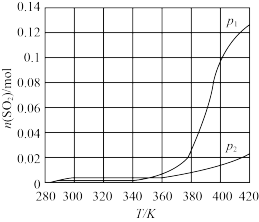
①科研团队研究了温度和压强对反应I(Bunsen反应)达到平衡时n(SO2)的影响如下图所示,则p1_____ p2(填“>”“<"或“=”)。
②为了促进HI的分解,某科研团队设计了两种选择性膜反应器,其示意图如下。已知:HI的分解在反应区内进行,膜可以对产物进行选择性释放。反应区内通过控制使压强恒定为100kPa。反应开始时,投料均为1mol的HI气体。膜反应器1中氢气的渗透速率为3.1×10-8mol/(s·Pa)。反应区内的部分实验数据显示在下表中。
(4)我国科学家在(自然-通讯》发表了低温高效催化丁烷脱氢制丁烯的研究成果。该过程易发生积炭和裂化等副反应,催化反应历程如图a所示[注:0.06ev表示1个C4H8(g)+1个H2(g)的能量)]
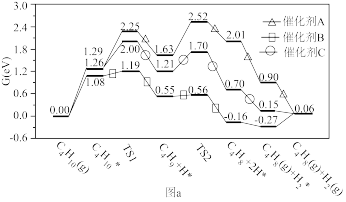
①三种催化剂催化效果最好的是_______ (填“A”、“B”或“C”),以C为催化剂时决速反应的方程式为_______ ;
②在一恒容密闭容器中通入1mol丁烷和适量的催化剂,发生催化脱氢反应,若起始投料量不变,经过相同时间,测得不同温度下丁烷转化率和丁烯产率如图b所示。温度高于T1时,丁烯产率降低的原因可能是_______ (写一条即可),温度高于T2时丁烷转化率增大的原因可能是_______ (写一条即可)。

(1)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H1=-907kJ∙mol-1;
②①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ∆H2=-1269.0kJ∙mol-1。
若4NH3(g)+6NO(g)=5N2(g)+6H2O(g)的逆反应活化能为E逆=akJ∙mol-1,则其正反应活化能为
(2)氢气选择性催化还原NO是一种比NH3还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如下图:

①Pt原子表面上发生的反应除N+N=N2、2H+O=H2O外还有
②已知在HY载体表面发生反应的NO、O2物质的量之比为1∶1,补充并配平下列离子方程式:
(3)硫碘循环(SI循环)是目前最有前景和研究最多的一个热化学循环。SI循环涉及如下两个反应:
反应I(Bunsen反应):SO2(g)+I2(s)+2H2O(l)⇌2HI(aq)+H2SO4(aq) ∆H1=akJ∙mol-1
反应II:2HI(aq)⇌H2(g)+I2(s) ∆H2=bkJ∙mol-1
①科研团队研究了温度和压强对反应I(Bunsen反应)达到平衡时n(SO2)的影响如下图所示,则p1

②为了促进HI的分解,某科研团队设计了两种选择性膜反应器,其示意图如下。已知:HI的分解在反应区内进行,膜可以对产物进行选择性释放。反应区内通过控制使压强恒定为100kPa。反应开始时,投料均为1mol的HI气体。膜反应器1中氢气的渗透速率为3.1×10-8mol/(s·Pa)。反应区内的部分实验数据显示在下表中。
| 反应器示意图 | 无膜反应器 | 膜反应器1 | 膜反应器2 |
 |  | ||
| 物质 | HI | H2 | |
| 80s后的平衡物质的量/mol | 0.78 | ||
| HI平衡分解率 | α1= | α2=52% | α3 |
(4)我国科学家在(自然-通讯》发表了低温高效催化丁烷脱氢制丁烯的研究成果。该过程易发生积炭和裂化等副反应,催化反应历程如图a所示[注:0.06ev表示1个C4H8(g)+1个H2(g)的能量)]

①三种催化剂催化效果最好的是
②在一恒容密闭容器中通入1mol丁烷和适量的催化剂,发生催化脱氢反应,若起始投料量不变,经过相同时间,测得不同温度下丁烷转化率和丁烯产率如图b所示。温度高于T1时,丁烯产率降低的原因可能是

2022·湖北武汉·模拟预测
类题推荐
氮的氧化物是大气污染物之一,研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)已知:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.0kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0kJ/mol
写出NH3与NO反应生成N2和H2O(g)的热化学方程式:_______ 。
(2)氢气选择性催化还原NO是一种比NH3还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:
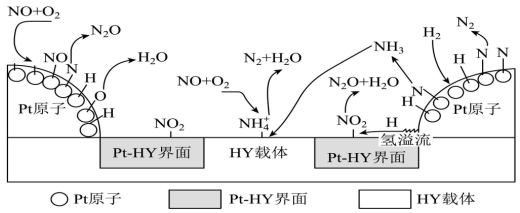
Pt原子表面上发生的反应除N+N=N2、2H+O=H2O外还有_______ 。
(3)在密闭容器中充入4molNO和5molH2,发生反应:2NO(g)+2H2(g) N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
N2(g)+2H2O(g) △H<0,平衡时NO的体积分数随温度、压强的变化关系如图。
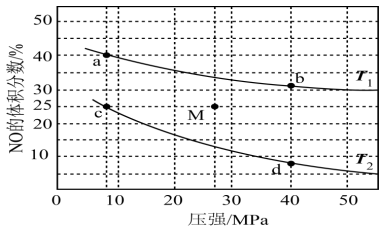
①下列物理量中,图中d点大于b点的是_______ (填字母)。
A.正反应速率 B.H2的转化率
C.N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为_______ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点:_______ 。
(4)T℃时,向容积为2L的恒容容器中充入0.4molNO、0.8molH2发生反应:2NO(g)+2H2(g) N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:
N2(g)+2H2O(g),体系的总压强p随时间t的变化如下表所示:
①0~20min内该反应的平均反应速率v(NO)= _______ mol/(L·min)。
②该温度下反应的平衡常数Kp=_______ kPa-1(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。
(1)已知:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1=-907.0kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0kJ/mol
写出NH3与NO反应生成N2和H2O(g)的热化学方程式:
(2)氢气选择性催化还原NO是一种比NH3还原NO更为理想的方法,备受研究者关注。以Pt-HY为催化剂,氢气选择性催化还原NO在催化剂表面的反应机理如图:

Pt原子表面上发生的反应除N+N=N2、2H+O=H2O外还有
(3)在密闭容器中充入4molNO和5molH2,发生反应:2NO(g)+2H2(g)

①下列物理量中,图中d点大于b点的是
A.正反应速率 B.H2的转化率
C.N2(g)的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的点:
(4)T℃时,向容积为2L的恒容容器中充入0.4molNO、0.8molH2发生反应:2NO(g)+2H2(g)
| t/min | 0 | 10 | 20 | 30 | 40 |
| p/kPa | 240 | 226 | 216 | 210 | 210 |
②该温度下反应的平衡常数Kp=
热化学循环分解水制氢是未来理想的制氢方法之一,其中硫碘循环(SI循环)是目前最有前景和研究最多的一个热化学循环。SI循环的三个反应如下。
反应Ⅰ(Bunsen反应):

反应Ⅱ:

反应Ⅲ:

请回答下列问题:
(1)SI循环制氢的总反应为 ,则其
,则其
_______ kJ/mol(用含a、b、c的代数式表示)。
(2)科研团队研究了温度和压强对反应Ⅰ(Bunsen反应)达到平衡时 的影响如下图所示,则
的影响如下图所示,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)为了促进HI的分解,某科研团队设计了两种选择性膜反应器,其示意图如下。已知:HI的分解在反应区内进行,膜可以对产物进行选择性释放。反应区内通过控制使压强恒定为100kPa.反应开始时,投料均为1mol的HI气体。膜反应器1中氢气的渗透速率为 。反应区内的部分实验数据显示在下表中。请填写下表中空格。
。反应区内的部分实验数据显示在下表中。请填写下表中空格。
(4)为了减少 的排放,SI循环系统可以与传统
的排放,SI循环系统可以与传统 矿化技术相结合,利用SI循环系统产生的强酸性废液固碳,其流程图如下图所示。将过程②得到的晶体在水解器中与水蒸气共热,发生水解反应③,生成碱式碘化物
矿化技术相结合,利用SI循环系统产生的强酸性废液固碳,其流程图如下图所示。将过程②得到的晶体在水解器中与水蒸气共热,发生水解反应③,生成碱式碘化物 固体。
固体。 固体溶于水后可以自动分解成氢氧化物和碘化物。根据信息,请写出下列化学方程式。
固体溶于水后可以自动分解成氢氧化物和碘化物。根据信息,请写出下列化学方程式。

反应过程①:_______ 。
水解反应③:_______ 。
反应Ⅰ(Bunsen反应):
反应Ⅱ:
反应Ⅲ:
请回答下列问题:
(1)SI循环制氢的总反应为
(2)科研团队研究了温度和压强对反应Ⅰ(Bunsen反应)达到平衡时
(3)为了促进HI的分解,某科研团队设计了两种选择性膜反应器,其示意图如下。已知:HI的分解在反应区内进行,膜可以对产物进行选择性释放。反应区内通过控制使压强恒定为100kPa.反应开始时,投料均为1mol的HI气体。膜反应器1中氢气的渗透速率为

| 反应器示意图 | 无膜反应器 | 膜反应器1 | 膜反应器2 |
 |  | ||
| 物质 | HI | ||
| 80 s后的平衡物质的量/mol | 0.78 | ||
| HI平衡分解率 |

反应过程①:
水解反应③:
减少CO2排放并实现CO2的有效转化已成为科研工作者的研究热点。根据以下两种常见的CO2利用方法,回答下列问题:
(I)在钌配合物催化作用下采用“CO2催化加氢制甲酸”方法将CO2资源化利用。
反应为:CO2(g)+H2(g) HCOOH(g) ΔH
HCOOH(g) ΔH
(1)已知:298K时,部分物质的相对能量如表所示,ΔH =_______ kJ·mol-1,该反应在_____ (填“高温”、“低温”或者“任意温度” )易自发进行。
(II)以氧化铟(In2O3)作催化剂,采用“CO2催化加氢制甲醇”方法将CO2资源化利用。反应历程如下:
i.催化剂活化:In2O3 (无活性) In2O3-x (有活性)
In2O3-x (有活性)
ii.CO2与H2在活化的催化剂表面同时发生如下反应:
反应①:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应②:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
(2)某温度下,在恒容密闭反应器发生以上反应,下列能说明反应①达到平衡状态的是___ (填标号)。
(3)增大CO2和H2混合气体的流速,可减少产物中H2O(g)的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:__________ 。
(4)ii中反应①、②的lnK(K代表化学平衡常数)随 ×103 (T代表温度)的变化如图所示
×103 (T代表温度)的变化如图所示

请在上述图中画出反应CO(g)+2H2(g) CH3OH(g)的 lnK 随
CH3OH(g)的 lnK 随 ×103变化的曲线
×103变化的曲线_______ 。
(5)在恒温密闭容器中,维持压强和投料比不变,将CO2和H2按一定流速通过反应器, CO2的转化率[α(CO2)%]和甲醇的选择性[x(CH3OH)%= ×100%]随着温度变化关系如图所示。
×100%]随着温度变化关系如图所示。
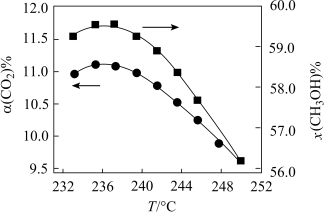
若233~251°C时催化剂的活性受温度影响不大,分析温度高于235°C时图中曲线下降的原因________ 。
(6)恒温恒压密闭容器中,加入2molCO2和4molH2,同时发生反应①和反应②,初始压强为p0,在300°C发生反应,反应达到平衡时,CO2的转化率为50%,容器体积减小20%,则反应②用平衡分压表示的平衡常数Kp=________ (保留两位有效数字)。
(I)在钌配合物催化作用下采用“CO2催化加氢制甲酸”方法将CO2资源化利用。
反应为:CO2(g)+H2(g)
(1)已知:298K时,部分物质的相对能量如表所示,ΔH =
物质 | CO2(g) | H2(g) | H2O(g) | CO(g) | HCOOH(g) |
相对能量/kJ ·mol-1) | -393 | 0 | -242 | -110 | -423.9 |
(II)以氧化铟(In2O3)作催化剂,采用“CO2催化加氢制甲醇”方法将CO2资源化利用。反应历程如下:
i.催化剂活化:In2O3 (无活性)
ii.CO2与H2在活化的催化剂表面同时发生如下反应:
反应①:CO2(g)+3H2(g)
反应②:CO2(g)+H2(g)
(2)某温度下,在恒容密闭反应器发生以上反应,下列能说明反应①达到平衡状态的是___ (填标号)。
| A.v正(H2):v逆(CH3OH)=3:1 |
| B.混合气体的平均摩尔质量保持不变 |
| C.混合气体的密度保持不变 |
| D.CH3OH(g)的分压保持不变 |
(4)ii中反应①、②的lnK(K代表化学平衡常数)随

请在上述图中画出反应CO(g)+2H2(g)
(5)在恒温密闭容器中,维持压强和投料比不变,将CO2和H2按一定流速通过反应器, CO2的转化率[α(CO2)%]和甲醇的选择性[x(CH3OH)%=

若233~251°C时催化剂的活性受温度影响不大,分析温度高于235°C时图中曲线下降的原因
(6)恒温恒压密闭容器中,加入2molCO2和4molH2,同时发生反应①和反应②,初始压强为p0,在300°C发生反应,反应达到平衡时,CO2的转化率为50%,容器体积减小20%,则反应②用平衡分压表示的平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


