解答题-原理综合题 较难0.4 引用1 组卷280
乙烯是石油化工最基本原料之一。
I.乙烷在一定条件下可脱氢制得乙烯:C2H6(g) C2H4(g)+H2(g) △H1>0
C2H4(g)+H2(g) △H1>0
(1)提高乙烷平衡转化率的措施有____ 、____ 。
(2)一定温度下,向恒容密闭容器通入等物质的量的C2H6和H2,初始压强为100kPa,发生上述反应,乙烷的平衡转化率为20%。平衡时体系的压强为___ kPa,该反应的平衡常数Kp=___ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
II.在乙烷中引入O2可以降低反应温度,减少积碳。涉及如下反应:
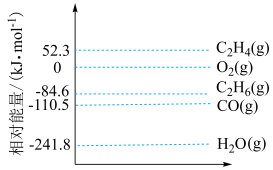
a.2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) △H2<0
b.2C2H6(g)+5O2(g)=4CO(g)+6H2O(g) △H3<0
c.C2H4(g)+2O2(g)=2CO(g)+2H2O(g) △H4<0
(3)根据盖斯定律,反应a的△H2=____ (写出用含有△H3、△H4表示的代数式)。
(4)氧气的引入可能导致过度氧化。为减少过度氧化,需要寻找催化剂降低反应____ (选填“a”、“b”或“c”)的活化能。
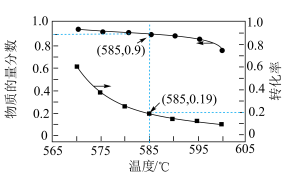
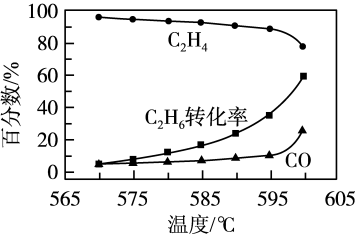
(5)常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。
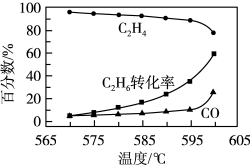
①乙烯的物质的量百分数随温度升高而降低的,原因是____ 。
②在570~600℃温度范围内,下列说法正确的有____ (填字母)。
A.H2O的含量随温度升高而增大.
B.C2H6在体系中的物质的量百分数随温度升高而增大
C.此催化剂的优点是在较低温度下能降低CO的平衡产率
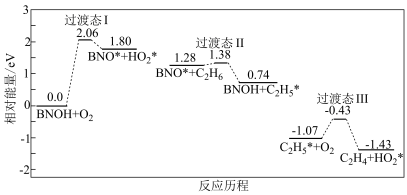
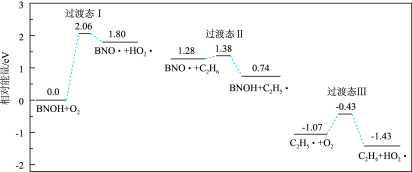
③某学者研究了生成C2H4的部分反应历程如图所示,写出该部分反应历程的总反应方程式____ 。该历程的催化剂是____ 。
I.乙烷在一定条件下可脱氢制得乙烯:C2H6(g)
(1)提高乙烷平衡转化率的措施有
(2)一定温度下,向恒容密闭容器通入等物质的量的C2H6和H2,初始压强为100kPa,发生上述反应,乙烷的平衡转化率为20%。平衡时体系的压强为
II.在乙烷中引入O2可以降低反应温度,减少积碳。涉及如下反应:
a.2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) △H2<0
b.2C2H6(g)+5O2(g)=4CO(g)+6H2O(g) △H3<0
c.C2H4(g)+2O2(g)=2CO(g)+2H2O(g) △H4<0
(3)根据盖斯定律,反应a的△H2=
(4)氧气的引入可能导致过度氧化。为减少过度氧化,需要寻找催化剂降低反应
(5)常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。

①乙烯的物质的量百分数随温度升高而降低的,原因是
②在570~600℃温度范围内,下列说法正确的有
A.H2O的含量随温度升高而增大.
B.C2H6在体系中的物质的量百分数随温度升高而增大
C.此催化剂的优点是在较低温度下能降低CO的平衡产率
③某学者研究了生成C2H4的部分反应历程如图所示,写出该部分反应历程的总反应方程式

2022·福建龙岩·模拟预测
类题推荐
我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g)⇌2CO(g)+2H2(g) △H1
b)CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2
c)CH4(g)⇌C(s)+2H2(g) △H3
d)2CO(g)⇌CO2(g)+C(s) △H4
e)CO(g)+H2(g)⇌H2O(g)+C(s) △H5
(1)根据盖斯定律,反应a的△H1=___________ (写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)设 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln 随1/T(温度的倒数)的变化如图所示。
随1/T(温度的倒数)的变化如图所示。
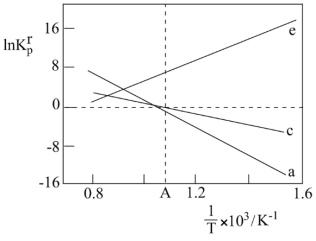
①反应a、c、e中,属于吸热反应的有___________ (填字母)。
②反应c的相对压力平衡常数表达式为 =
=___________ 。
③在图中A点对应温度下,原料组成为n(CO2):n(CH4)=1:1,初始总压为100kPa的恒容密闭容器中进行反应c,体系达到平衡时H2的分压为40kPa,CH4的平衡转化率为___________ 。
(4)工业上在一定催化剂作用下用CO2氧化C2H6制C2H4,发生主反应I和副反应II
I.C2H6(g)+CO2(g)⇌C2H4(g)+H2O(g)+CO(g) △H=+177kJ·mol-l
II.C2H6(g)+2CO2(g)⇌3H2(g)+4CO(g) △H=+430kJ·mol-l
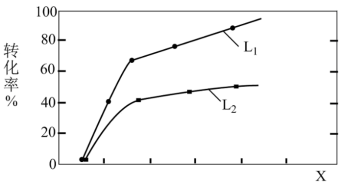
在1.0L密闭容器中,控制C2H6和CO2初始投料量为2mol和3mol,乙烷的平衡转化率与温度、压强的关系如图所示。则X代表_______ (填“温度”或“压强”);L1_______ L2(填“>”或“<”),理由是________ 。
a)CH4(g)+CO2(g)⇌2CO(g)+2H2(g) △H1
b)CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2
c)CH4(g)⇌C(s)+2H2(g) △H3
d)2CO(g)⇌CO2(g)+C(s) △H4
e)CO(g)+H2(g)⇌H2O(g)+C(s) △H5
(1)根据盖斯定律,反应a的△H1=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| B.移去部分C(s),反应c、d、e的平衡均向右移动。 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |

①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为
③在图中A点对应温度下,原料组成为n(CO2):n(CH4)=1:1,初始总压为100kPa的恒容密闭容器中进行反应c,体系达到平衡时H2的分压为40kPa,CH4的平衡转化率为
(4)工业上在一定催化剂作用下用CO2氧化C2H6制C2H4,发生主反应I和副反应II
I.C2H6(g)+CO2(g)⇌C2H4(g)+H2O(g)+CO(g) △H=+177kJ·mol-l
II.C2H6(g)+2CO2(g)⇌3H2(g)+4CO(g) △H=+430kJ·mol-l
在1.0L密闭容器中,控制C2H6和CO2初始投料量为2mol和3mol,乙烷的平衡转化率与温度、压强的关系如图所示。则X代表

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网