解答题-结构与性质 适中0.65 引用1 组卷113
1998年,LiW,Dhandapani B等制备了一种具有良好加氢脱氮性质的催化剂 ,开辟了一类全新的催化材料。近年来,过渡金属磷化物(
,开辟了一类全新的催化材料。近年来,过渡金属磷化物( )作为一种新型催化材料,开始广泛应用在电化学、生物学、光学、催化等方面。常见的过渡金属磷化物有
)作为一种新型催化材料,开始广泛应用在电化学、生物学、光学、催化等方面。常见的过渡金属磷化物有 、
、 、
、 、
、 、
、 、
、 等,在金属磷化物中金属原子围绕着非金属原子形成正三棱柱,非金属原子位于正三棱柱的中心。请回答下列问题:
等,在金属磷化物中金属原子围绕着非金属原子形成正三棱柱,非金属原子位于正三棱柱的中心。请回答下列问题:
(1)基态磷原子的价电子排布式为_______ 。基态 与
与 中未成对电子数之比为
中未成对电子数之比为_______ 。
(2) 、P、S三种元素的第一电离能由大到小的顺序是
、P、S三种元素的第一电离能由大到小的顺序是_______ 。电负性:P_______ As(填“>、=或<”),原因是_______ 。
(3) 分子的空间构型为
分子的空间构型为_______ ,其中P的杂化轨道类型为_______ 杂化。
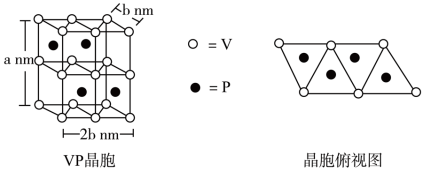
(4)磷化钒( )的晶胞结构如图所示,V作简单六方棱柱体排列,P交替地填入一半的V的正三棱柱中心空隙。与V原子距离相等且最近的P原子有
)的晶胞结构如图所示,V作简单六方棱柱体排列,P交替地填入一半的V的正三棱柱中心空隙。与V原子距离相等且最近的P原子有_______ 个,晶胞的各参数见下图,设阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为_______  。(列出计算式)
。(列出计算式)
(1)基态磷原子的价电子排布式为
(2)
(3)
(4)磷化钒(

21-22高二下·浙江·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网