解答题-结构与性质 适中0.65 引用1 组卷172
TIC、TiN、MnS、MnSe在电化学领域均有巨大的应用潜力。回答下列问题:
(1)基态Ti2+和Mn2+中未成对电子数之比为_______ ;N、S、Mn的第一电离能由大到小的顺序为_______ 。
(2)键能:H—S_______ H—Se(填“>”或“<"),理由为_______ 。
(3)C3N4的硬度可以和金刚石媲美,其中N原子的杂化方式为_______ 。
(4)SeO2的VSEPR模型为_______ 。
(5)H2S2O8是一种强氧化剂,可看作两个H2SO4分子通过形成过氧键结合而成。1molH2S2O8中σ键的数目为_______ 。
(6)MnSe具有NaCl型结构,其立方晶胞结构如图1所示。
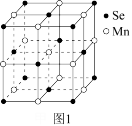
①MnSe晶体可以看成是由Se原子堆成的正八面体中空隙被Mn原子填充,填充率为_______ 。
②图2所示单元不是MnSe的晶胞单元,原因为_______ 。

③若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则该晶体中Se原子与Mn原子之间最短距离为_______ pm。
(1)基态Ti2+和Mn2+中未成对电子数之比为
(2)键能:H—S
(3)C3N4的硬度可以和金刚石媲美,其中N原子的杂化方式为
(4)SeO2的VSEPR模型为
(5)H2S2O8是一种强氧化剂,可看作两个H2SO4分子通过形成过氧键结合而成。1molH2S2O8中σ键的数目为
(6)MnSe具有NaCl型结构,其立方晶胞结构如图1所示。

①MnSe晶体可以看成是由Se原子堆成的正八面体中空隙被Mn原子填充,填充率为
②图2所示单元不是MnSe的晶胞单元,原因为

③若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则该晶体中Se原子与Mn原子之间最短距离为
2022·山西吕梁·二模
类题推荐
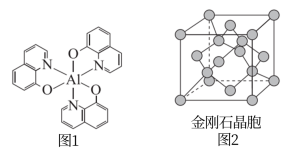
光电材料在能源军事等领域有重要应用,分为无机光电材料如ZnS、ZnSe、GaAs、 等,及有机光电材料(如图1所示化合物)。回答下列问题:
等,及有机光电材料(如图1所示化合物)。回答下列问题:
(1)基态Zn原子的价层电子排布图为_____ ;Ga、As、Se的第一电离能由大到小的顺序为___________ 。
(2)图1所示化合物中所含有的化学键类型有_____ (填选项字母),N原子的杂化方式为_____ 。
A.共价键 B.离子键 C.配位键 D.氢键
(3)在水溶液中,以 为电子供体,
为电子供体, 在
在 光催化剂上可还原为CO,部分氧化物的沸点如表所示:
光催化剂上可还原为CO,部分氧化物的沸点如表所示:
①表中氧化物之间沸点差异的原因为___________ 。
② 的VSEPR模型为
的VSEPR模型为___________ 。
③ 和
和 分子中,键角更大的是
分子中,键角更大的是___________ 。
(4)ZnS和ZnSe晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2)内部的碳原子用Zn代替,晶胞顶角与面心位置的碳原子被S或Se代替。
①ZnS晶体中,Zn原子在S原子围成的正四面体空隙中的占用率为___________ 。
②若阿伏加德罗常数的值为 ,ZnS晶体的密度为
,ZnS晶体的密度为 ,ZnSe晶体的密度为
,ZnSe晶体的密度为 ,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为
,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为___________ 。
(1)基态Zn原子的价层电子排布图为
(2)图1所示化合物中所含有的化学键类型有
A.共价键 B.离子键 C.配位键 D.氢键

(3)在水溶液中,以
| 氧化物 | |||
| 沸点/℃ | 100 | -10 | -78.5 |
②
③
(4)ZnS和ZnSe晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2)内部的碳原子用Zn代替,晶胞顶角与面心位置的碳原子被S或Se代替。
①ZnS晶体中,Zn原子在S原子围成的正四面体空隙中的占用率为
②若阿伏加德罗常数的值为
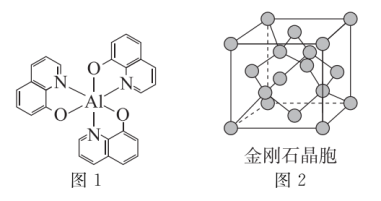
光电材料在能源、军事等领域有重要应用,分为无机光电材料如ZnS、ZnSe、GaAs、 等,及有机光电材料(如图1所示化合物)。回答下列问题:
等,及有机光电材料(如图1所示化合物)。回答下列问题:
(1)基层Zn原子的价层电子排布图为___________ ;Ga、As、Se的第一电离能由大到小的顺序为___________ 。
(2)图1所示化合物中含有的化学键类型有___________ (填选项字母),N原子的杂化方式为___________ 。
A.共价键 B.离子键 C.配位键 D.氢键
(3)在水溶液中,以 为电子供体,
为电子供体, 在
在 光催化剂上可还原为CO,部分氧化物的沸点如表所示:
光催化剂上可还原为CO,部分氧化物的沸点如表所示:
①表中氧化物之间沸点差异的原因为___________ 。
② 的VSEPR模型为
的VSEPR模型为___________ 。
③ 和
和 分子中,键角更大的是
分子中,键角更大的是___________ (填化学式)。
(4)ZnS和ZnSe晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2)内部的碳原子用Zn代替,晶胞顶角与面心位置的碳原子被S或Se代替。
①ZnS晶体中,一个晶胞含有S原子数目为___________ 。
②若阿伏加德罗常数的值为 ,ZnS晶体的密度为
,ZnS晶体的密度为 ,ZnSe晶体的密度为
,ZnSe晶体的密度为 ,则ZnS晶体与ZnSe晶体的晶胞参数之比为
,则ZnS晶体与ZnSe晶体的晶胞参数之比为___________ 。
(1)基层Zn原子的价层电子排布图为
(2)图1所示化合物中含有的化学键类型有
A.共价键 B.离子键 C.配位键 D.氢键

(3)在水溶液中,以
| 氧化物 | |||
| 沸点/ | 100 |
①表中氧化物之间沸点差异的原因为
②
③
(4)ZnS和ZnSe晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2)内部的碳原子用Zn代替,晶胞顶角与面心位置的碳原子被S或Se代替。
①ZnS晶体中,一个晶胞含有S原子数目为
②若阿伏加德罗常数的值为
Cu、Zn及其化合物在生产、生活中有着重要作用。请回答:
(1)Cu、Zn在周期表中__________ 区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式__________ 。
(2)Zn的某种化合物M是很好的补锌剂,结构式如图:__________ 。
②常见含氮的配体有 等,
等, 的分子空间构型为
的分子空间构型为__________ , 的中心氮原子杂化方式为
的中心氮原子杂化方式为__________ 。
(3)卤化锌的熔点如表:
则 熔点如表变化的原因是
熔点如表变化的原因是__________ 。
(4)MnSe具有NaCl型结构,其立方晶胞结构如图1所示。__________ 。
②图2所示单元不是MnSe的晶胞单元,原因为__________ 。 ,晶体密度为
,晶体密度为 ,则该晶体中Se原子与Mn原子之间最短距离为
,则该晶体中Se原子与Mn原子之间最短距离为__________ pm。
(1)Cu、Zn在周期表中
(2)Zn的某种化合物M是很好的补锌剂,结构式如图:

②常见含氮的配体有
(3)卤化锌的熔点如表:
| 卤化锌/ | |||
| 熔点/℃ | 872 | 283 | 394 |
(4)MnSe具有NaCl型结构,其立方晶胞结构如图1所示。

②图2所示单元不是MnSe的晶胞单元,原因为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


