解答题-原理综合题 较难0.4 引用1 组卷150
我国力争于2030年前做到碳达峰,2080年前实现碳中和。利用CO2合成工业产品是目前的科研热点之一,已知:
Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.
回答下列问题:
(1)二氧化碳与氢气生成甲醇蒸气和水蒸气的热化学方程式为_______ 。
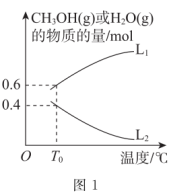
(2)一定条件下。向10L恒容密闭容器中充入lmol CO2(g)和2mol H2(g)发生上述III、IV反应,实验测得反应平衡时CH3OH(g) 、H2O(g)的物质的量与压强的关系如图所示。
①图中表示H2O(g)和CH3OH(g)的物质的量与压强关系的曲线为_______ 、_______ (填“L1”或“L2”)。
②PaMPa时。若反应在5min时恰好达到平衡状态,则反应的平均速率v(CO2)_______ ;该温度下,反应Ⅲ的化学平衡常数K =_______ 。
(3)不同催化剂对产物的量会产生影响。在其他条件相同时,添加不同催化剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。欲提高单位时同内甲醇的产量,使用催化剂_______ 效果最好。
(4)在催化剂作用下CO2加氢可制得甲醇,该反应历程如图所示(吸附在催化剂表面的物质用*标注,如* CO2表示CO2吸附在催化剂表面:图中* H已省略)。
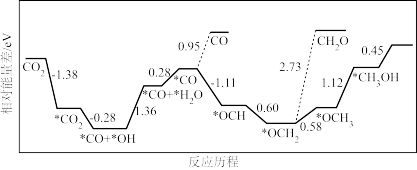
上述合成甲醇的反应速率较慢,该反应过程中决速步反应的化学方程式为_______ ,提高产物中甲醇选择性的方法是_______ 。
Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.
回答下列问题:
(1)二氧化碳与氢气生成甲醇蒸气和水蒸气的热化学方程式为
(2)一定条件下。向10L恒容密闭容器中充入lmol CO2(g)和2mol H2(g)发生上述III、IV反应,实验测得反应平衡时CH3OH(g) 、H2O(g)的物质的量与压强的关系如图所示。

①图中表示H2O(g)和CH3OH(g)的物质的量与压强关系的曲线为
②PaMPa时。若反应在5min时恰好达到平衡状态,则反应的平均速率v(CO2)
(3)不同催化剂对产物的量会产生影响。在其他条件相同时,添加不同催化剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。欲提高单位时同内甲醇的产量,使用催化剂
| 催化剂 | CO2转化率(%) | 各产物在总产物中的占比(%) | ||
| CH3OH | CH3CH2OH | 其他 | ||
| A | 30.5 | 35.9 | 39.6 | 24.5 |
| B | 27.2 | 75.6 | 22.8 | 1.6 |
| C | 19.8 | 80.7 | 12.5 | 16.8 |
(4)在催化剂作用下CO2加氢可制得甲醇,该反应历程如图所示(吸附在催化剂表面的物质用*标注,如* CO2表示CO2吸附在催化剂表面:图中* H已省略)。

上述合成甲醇的反应速率较慢,该反应过程中决速步反应的化学方程式为
21-22高二下·广东·阶段练习
类题推荐
我国高度重视双碳工作实施和目标实现,致力研发二氧化碳综合利用的措施和途径。
已知: I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g) ΔH₂=+41.2kJ⋅mol-1
CO(g)+H2O(g) ΔH₂=+41.2kJ⋅mol-1
Ⅲ.相关化学键的键能数据如表所示。
回答下列问题:
(1)一氧化碳与氢气合成甲醇气的热化学方程式为________ 。
(2)研究表明,反应Ⅱ在催化剂上的反应机理如下。其中各物种吸附在催化剂表面活性位的原子用*标注,如*CO表示CO中C原子吸附在催化剂表面。
I.CO2(g)+H2(g)+H2O(g)= CO2(g)+H2(g)+H2O
II.CO2(g)+H2(g)+H2O*=*COOH+2H*+HO*;
III.*COOH+2H*+HO*= COOH+H*+H2O*;
iV.*COOH+H*+H2O*=*CO+H2O*+H*+H2O(g);
V.*CO+*OH+H*+H2O(g)= *CO+H2O*+H2O(g);
Vi.*CO+H2O*+H2Og= CO(g)+2H2O(g)。
①H2O的作用为生成物和________ 。
②该历程中,脱附和吸附的能量很低,速率控制步骤(即速率最慢步骤)为并骤_____ (填序号),理由是____ 。
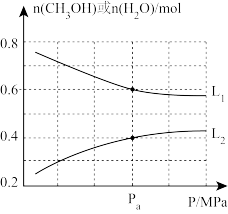
(3)向10 L 恒容密闭容器中充入 和
和  发生反应Ⅰ和反应Ⅱ,实验测得体系中
发生反应Ⅰ和反应Ⅱ,实验测得体系中  的平衡物质的量分数与温度和压强的关系如图所示。
的平衡物质的量分数与温度和压强的关系如图所示。______ ,推断的依据为______ 。
②若M点对应条件下,容器中CH3OH(g)的物质的量分数为12.5%,则该条件下H2的平衡转化率为____ ,反应Ⅰ的平衡常数 
____  (列出计算式)。
(列出计算式)。
③M、N两点对应状态下反应Ⅱ的平衡常数 Kp(M)____ Kp(N)(填“>”“<”或“=”)。
已知: I.CO2(g)+3H2(g)
II.CO2(g)+H2(g)
Ⅲ.相关化学键的键能数据如表所示。
| 化学键 | C=O | H—H | C—H | C—O | O—H |
| 键能/(kJ·mol⁻¹) | 803.0 | 436.0 | 413.4 | 351 | 462.8 |
(1)一氧化碳与氢气合成甲醇气的热化学方程式为
(2)研究表明,反应Ⅱ在催化剂上的反应机理如下。其中各物种吸附在催化剂表面活性位的原子用*标注,如*CO表示CO中C原子吸附在催化剂表面。
I.CO2(g)+H2(g)+H2O(g)= CO2(g)+H2(g)+H2O
II.CO2(g)+H2(g)+H2O*=*COOH+2H*+HO*;
III.*COOH+2H*+HO*= COOH+H*+H2O*;
iV.*COOH+H*+H2O*=*CO+H2O*+H*+H2O(g);
V.*CO+*OH+H*+H2O(g)= *CO+H2O*+H2O(g);
Vi.*CO+H2O*+H2Og= CO(g)+2H2O(g)。
①H2O的作用为生成物和
②该历程中,脱附和吸附的能量很低,速率控制步骤(即速率最慢步骤)为并骤
(3)向10 L 恒容密闭容器中充入
②若M点对应条件下,容器中CH3OH(g)的物质的量分数为12.5%,则该条件下H2的平衡转化率为
③M、N两点对应状态下反应Ⅱ的平衡常数 Kp(M)
CO2的资源化利用能有效减少CO2排放缓解能源危机,有助于实现碳达峰、碳中和。
I.CO2催化加氢制甲醇(CH3OH)
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
③ CO(g)+H2(g)
CO(g)+H2(g)
 CH3OH(g) ΔH3=-45.1kJ/mol
CH3OH(g) ΔH3=-45.1kJ/mol
(1)反应①的ΔH1=____ 。
(2)在催化剂作用下CO2加氢可制得甲醇,该反应历程如图所示(吸附在催化剂表面的物质用*标注,如*CO2表示CO2吸附在催化剂表面;图中*H已省略)。
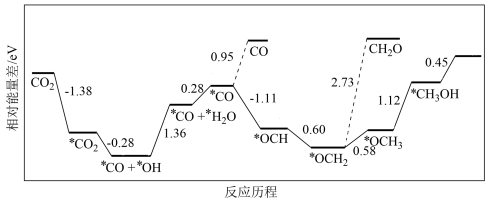
上述合成甲醇的反应速率较慢,该反应过程中决速步反应的化学方程式为____ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有____ 。
II:CO2催化(固体催化剂)加氢合成甲烷
主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1=-165kJ·mol-1
CH4(g)+2H2O(g) ΔH1=-165kJ·mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.1kJ·mol-1
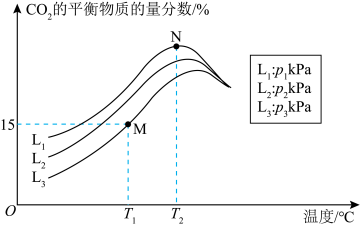
在不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性(CH4选择性= )随温度变化的影响如图所示。
)随温度变化的影响如图所示。
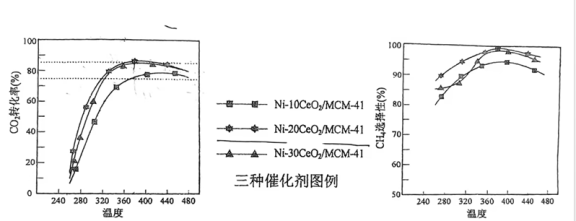
(4)对比上述三种催化剂的催化性能,工业上选择的催化剂是Ni-20CeO2/MCM-41,其使用的合适温度为____ ℃左右(填选项)。
A.300 B.340 C.380 D.420
当温度高于400℃时,CO2转化率和生成CH4选择性均有所下降,其原因可能是____ 。(答出一点即可)
(5)向某恒容密闭容器中充入一定量的CO2和H2,其分压分别为0.85MPa、2.7MPa,在温度t℃,某催化剂催化下发生甲烷化反应,一段时间后,主、副反应均达平衡(不考虑其它副反应),测得容器内CH4和H2O的分压分别为0.6MPa、1.25MPa,则主反应的分压平衡常数Kp=____ MPa-2。
I.CO2催化加氢制甲醇(CH3OH)
①CO2(g)+3H2(g)
②CO2(g)+H2(g)
③
(1)反应①的ΔH1=
(2)在催化剂作用下CO2加氢可制得甲醇,该反应历程如图所示(吸附在催化剂表面的物质用*标注,如*CO2表示CO2吸附在催化剂表面;图中*H已省略)。

上述合成甲醇的反应速率较慢,该反应过程中决速步反应的化学方程式为
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有
| A.加压,反应②的平衡不移动,化学平衡常数不变 |
| B.增大H2的浓度,有利于提高CO2的平衡转化率 |
| C.加入催化剂,可以降低反应的反应热 |
| D.及时分离除CH3OH,循环利用CO2和H2,可以提高反应速率和原料的利用率 |
II:CO2催化(固体催化剂)加氢合成甲烷
主反应:CO2(g)+4H2(g)
副反应:CO2(g)+H2(g)
在不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性(CH4选择性=

(4)对比上述三种催化剂的催化性能,工业上选择的催化剂是Ni-20CeO2/MCM-41,其使用的合适温度为
A.300 B.340 C.380 D.420
当温度高于400℃时,CO2转化率和生成CH4选择性均有所下降,其原因可能是
(5)向某恒容密闭容器中充入一定量的CO2和H2,其分压分别为0.85MPa、2.7MPa,在温度t℃,某催化剂催化下发生甲烷化反应,一段时间后,主、副反应均达平衡(不考虑其它副反应),测得容器内CH4和H2O的分压分别为0.6MPa、1.25MPa,则主反应的分压平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网