解答题-结构与性质 较难0.4 引用1 组卷119
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,2p轨道上有2个未成对电子,最外层电子数是内层电子数的3倍。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z基态核外电子排布式为:_______ 。
(2) 的空间构型是
的空间构型是_______ 。
(3)结构简式为 的化合物中R原子的杂化轨道类型为
的化合物中R原子的杂化轨道类型为_______ ; 分子中含有
分子中含有 键数目为
键数目为_______ 。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的 ,可生成
,可生成 ,下列说法正确的是_______(填字母)。
,下列说法正确的是_______(填字母)。
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
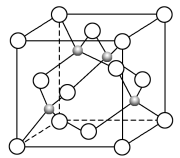
①该晶体的化学式为_______ 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于_______ (填“离子”或“共价”)化合物。
③已知该晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体中Z原子和Y原子之间的最短距离为
,则该晶体中Z原子和Y原子之间的最短距离为_______  (只写计算式)(Z原子位于体对角线上)。
(只写计算式)(Z原子位于体对角线上)。
(1)Z基态核外电子排布式为:
(2)
(3)结构简式为
(4)往Z的硫酸盐溶液中通入过量的
| A.在 |
| B. |
| C. |
| D. |

①该晶体的化学式为
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于
③已知该晶体的密度为
21-22高二下·辽宁·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网