解答题-原理综合题 较难0.4 引用1 组卷86
回答下列问题:
(1)一种工业制备甲醇的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
已知:①CO(g)+H2O(g) CO2(g)+H2(g) △H1=-40.9kJ·mol-1
CO2(g)+H2(g) △H1=-40.9kJ·mol-1
②CO(g)+2H2(g) CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1
试计算制备反应的△H=____ 。
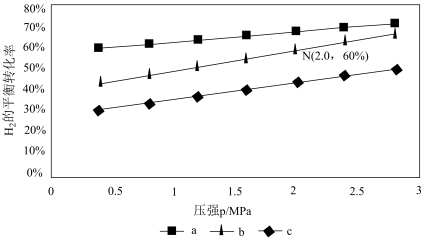
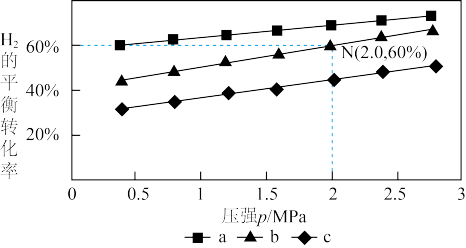
(2)对于反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
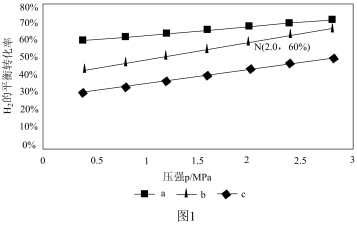
①比较a、b、c各曲线所表示的投料比大小顺序为____ (用字母表示)。
②点N在线b上,计算540K的压强平衡常数Kp=____ (用平衡分压计算)。
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时。v正:v逆=____ 。
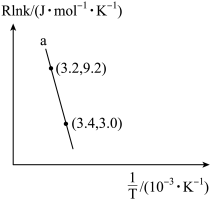
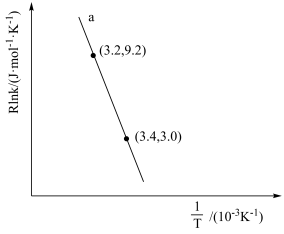
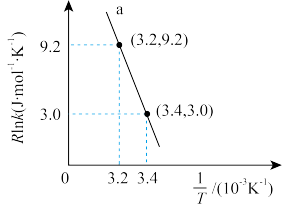
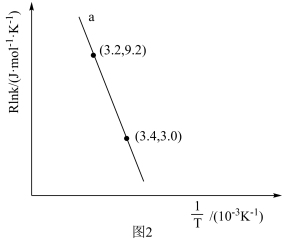
(3)甲醇催化可制取丙烯的反应为:3CH3OH(g) C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=- +C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=____ kJ·mol-1。
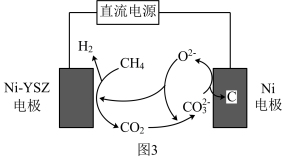
(4)甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法,其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:____ 。
(1)一种工业制备甲醇的反应为CO2(g)+3H2(g)
已知:①CO(g)+H2O(g)
②CO(g)+2H2(g)
试计算制备反应的△H=
(2)对于反应CO2(g)+3H2(g)

①比较a、b、c各曲线所表示的投料比大小顺序为
②点N在线b上,计算540K的压强平衡常数Kp=
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时。v正:v逆=
(3)甲醇催化可制取丙烯的反应为:3CH3OH(g)

(4)甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法,其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:

2022高二下·河南濮阳·学业考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网