解答题-原理综合题 较难0.4 引用1 组卷266
二甲醚又称甲醚,是一种十分重要的化工原料,在制药、燃料、农药等化学工业中有许多独特的用途。一定条件下,利用合成气(CO、H2)合成二甲醚,其中主要包括以下三个相互联系的反应:
i.合成气合成甲醇:CO(g) +2H2 (g) CH3OH(g);
CH3OH(g);
ii.甲醇脱水生成二甲醚:2CH3OH(g) CH3OCH3(g)+ H2O(g);
CH3OCH3(g)+ H2O(g);
iii.水煤气变换反应:CO(g)+ H2O(g) CO2(g)+ H2(g)。
CO2(g)+ H2(g)。
请回答下列问题:
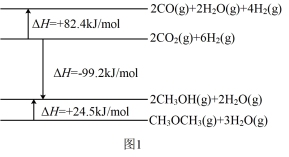
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:_______ 。
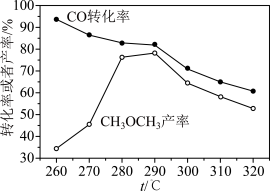
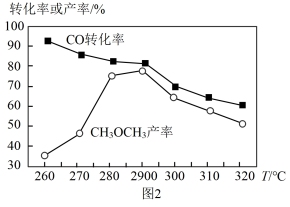
(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是_______ 。
(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
①平衡后,整个过程中CO的转化率为_______ ;v(CH3OCH3)=_______ mol· L-1· h-1。
②反应ii的K=_______ (保留两位小数)。
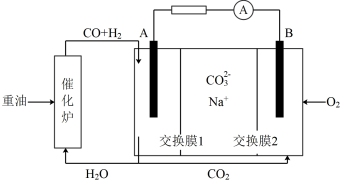
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为_______ ,假设催化炉产生的CO与H2的物质的量之比为2:1,电极A处产生的CO2有部分参与循环利用,其利用率为_______ 。
i.合成气合成甲醇:CO(g) +2H2 (g)
ii.甲醇脱水生成二甲醚:2CH3OH(g)
iii.水煤气变换反应:CO(g)+ H2O(g)
请回答下列问题:
(1)已知相关物质变化的焓变如图1所示,写出CO直接加氢合成二甲醚的热化学方程式:

(2)有研究者在催化剂(CuO/ZnO/Al2O3)、压强为5.0 MPa的条件下,由CO和H2直接制备二甲醚,结果如图2所示,其中CO转化率随温度升高而降低的原因是

(3)实验室模拟上述合成过程,在1 L恒容密闭容器中充入6 mol CO和6 mol H2,连续发生以上i、ii、iii反应,2 h后达到平衡,测得混合体系中各组分浓度如下表:
| 物质 | H2 | CH3OH | H2O | CO2 |
| 物质的量浓度/(mol·L-1) | l.44 | 0. 78 | 0. 12 | 0.84 |
②反应ii的K=
(4)合成气可做燃料电池的燃料。一种熔融盐燃料电池的工作原理如图所示,电极A上H2参与的电极反应为

2022·山西晋中·二模
类题推荐
二甲醚是一种十分重要的化工原料,可用来制杀虫剂、抛光剂、防锈剂、烷基化剂、溶剂等,工业上利用“一步法”合成二甲醚的总反应为2CO(g)+4H2(g)  CH3OCH3(g)+H2O(g) ΔH=—221.51 kJ·mol-1,回答下列问题:
CH3OCH3(g)+H2O(g) ΔH=—221.51 kJ·mol-1,回答下列问题:
(1)600 °C时,在复合催化剂CuO/ZnO/Al2O3上合成二甲醚的过程如下:
ⅰ.合成气合成甲醇:CO(g) +2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
ⅱ.甲醇脱水生成二甲醚:2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH2=—20.59 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH2=—20.59 kJ·mol-1
ⅲ.水煤气变换反应:CO(g)+H2O(g) CO2(g)+ H2(g) ΔH3=—38.7 kJ·mol-1
CO2(g)+ H2(g) ΔH3=—38.7 kJ·mol-1
①ΔH1=___________ kJ·mol-1。
②传统合成法将反应i、ii分别在不同的反应器中进行,“一步法”连续发生以上i、ii、iii三步反应,“一步法”的优点是___________ 。
(2)实验室模拟上述“一步法”合成过程,在1 L容器中充入6 molCO和6 mol H2,t h后达到平衡,测得混合体系中各组分浓度如下表:
平衡后,整个过程中CO的转化率为___________ ,第ii步反应放出的热量为___________ kJ(保留一位小数),v(CH3OCH3)=___________ mol· L-1·h-1,第ii步反应的K=___________ (保留两位小数)。
(3)第iii步反应机理中,调控反应条件,CO和OH在催化剂上相互作用得到CO2和H的氧化还原机理和羧基机理的两种不同途径如图所示。

分析图象可知,以上过程为___________ ( 填“放热”或“吸热”)过程,从第一步来看,___________ (填“氧化还原机理”或“羧基机理”)对合成有利,最终选择另一反应机理途径更有利的原因是___________ 。
(1)600 °C时,在复合催化剂CuO/ZnO/Al2O3上合成二甲醚的过程如下:
ⅰ.合成气合成甲醇:CO(g) +2H2(g)
ⅱ.甲醇脱水生成二甲醚:2CH3OH(g)
ⅲ.水煤气变换反应:CO(g)+H2O(g)
①ΔH1=
②传统合成法将反应i、ii分别在不同的反应器中进行,“一步法”连续发生以上i、ii、iii三步反应,“一步法”的优点是
(2)实验室模拟上述“一步法”合成过程,在1 L容器中充入6 molCO和6 mol H2,t h后达到平衡,测得混合体系中各组分浓度如下表:
| 物质 | H2 | CH3OH | H2O | CO2 |
| 物质的量浓度/(mol· L-1) | 1.956 | 0.72 | 0.084 | 0.756 |
平衡后,整个过程中CO的转化率为
(3)第iii步反应机理中,调控反应条件,CO和OH在催化剂上相互作用得到CO2和H的氧化还原机理和羧基机理的两种不同途径如图所示。

分析图象可知,以上过程为
二甲醚是一种重要的清洁燃料,可替代氟氯代烷作制冷剂,利用水煤气合成二甲醚的三步反应如下:
2H2(g)+CO(g)=CH3OH(g) ΔH=-90.8 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
请回答下列问题。
(1)由 H2和CO直接制备二甲醚的总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的ΔH=________ 。一定条件下的密闭容器中,该总反应达到平衡,要提高CO的平衡转化率,可以采取的措施有________ (填字母代号)。
a.高温高压 b.加入催化剂 c.分离出CO2
d.增加CO的量 e.分离出二甲醚
(2)某温度下反应2CH3OH(g) CH3OCH3(g)+H2O(g)的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正___ (填“>”“<”或“=”)v逆。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________ ,该时间段内v(CH3OH)=________ 。
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0 MPa的条件下,在相同时间内测得CH3OCH3产率随温度变化的曲线如图甲所示。其中CH3OCH3产率随温度升高而降低的原因可能是_____________________________________ 。
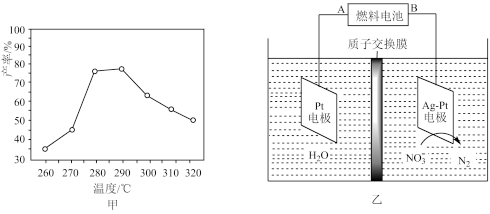
(4)二甲醚直接燃料电池具有启动快、效率高、能量密度高等优点,可用于电化学降解治理水中硝酸盐的污染。电化学降解NO3-的原理如图乙所示。若电解质为酸性,二甲醚直接燃料电池的负极反应式为____________________ ;若电解过程中转移了2 mol电子,则阳极室减少的质量为_________ g。
2H2(g)+CO(g)=CH3OH(g) ΔH=-90.8 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.3 kJ·mol-1
请回答下列问题。
(1)由 H2和CO直接制备二甲醚的总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的ΔH=
a.高温高压 b.加入催化剂 c.分离出CO2
d.增加CO的量 e.分离出二甲醚
(2)某温度下反应2CH3OH(g)
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0 MPa的条件下,在相同时间内测得CH3OCH3产率随温度变化的曲线如图甲所示。其中CH3OCH3产率随温度升高而降低的原因可能是

(4)二甲醚直接燃料电池具有启动快、效率高、能量密度高等优点,可用于电化学降解治理水中硝酸盐的污染。电化学降解NO3-的原理如图乙所示。若电解质为酸性,二甲醚直接燃料电池的负极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网