解答题-工业流程题 较难0.4 引用1 组卷195
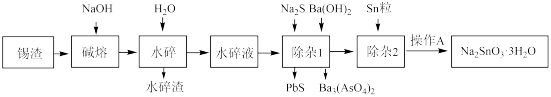
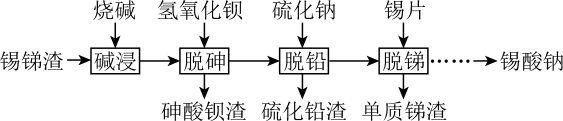
锡是大名鼎鼎的“五金”之一,早在远古时代人们便发现并加以利用。现从电镀锡渣(主要成分为Sn、SnO,含有砷和难溶于酸碱的杂质)中制取二水合氯化亚锡和锡酸钠,工艺流程如图所示:
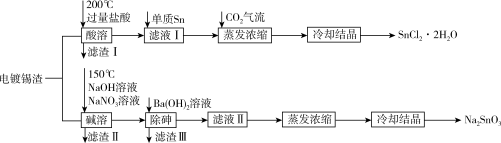
已知:①Sn(Ⅱ)具有还原性,可与Cl-形成[SnCl3]-;②As在碱溶时转化为Na3AsO4溶液;③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)在自然界中,锡很少以游离态存在但是远古时期人们已经会冶炼Sn,采用的方法是____ 。
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为_______ 。
(3)“酸溶”时SnO发生反应的离子方程式为____ 。在CO2气流中蒸发浓缩的目的是_____ 。
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn在该步骤中发生反应的化学方程式_______ 。
(5)“滤液I”中,需加入少量单质Sn,原因除了防止Sn(Ⅱ)被氧化,还有_______ 。
(6)“除砷”时,若溶液中c( )=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为
)=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为_______ 。
(7)蒸发浓缩“滤液Ⅱ”前,可往体系中加入适量的NaOH溶液,目的是_______ 。

已知:①Sn(Ⅱ)具有还原性,可与Cl-形成[SnCl3]-;②As在碱溶时转化为Na3AsO4溶液;③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)在自然界中,锡很少以游离态存在但是远古时期人们已经会冶炼Sn,采用的方法是
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为
(3)“酸溶”时SnO发生反应的离子方程式为
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn在该步骤中发生反应的化学方程式
(5)“滤液I”中,需加入少量单质Sn,原因除了防止Sn(Ⅱ)被氧化,还有
(6)“除砷”时,若溶液中c(
(7)蒸发浓缩“滤液Ⅱ”前,可往体系中加入适量的NaOH溶液,目的是
2022·黑龙江哈尔滨·模拟预测
类题推荐
以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4•H2O,其主要实验流程如下:
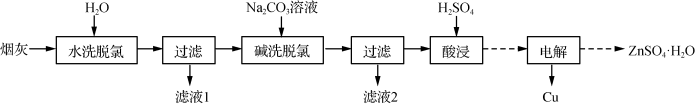
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85℃条件下进行,适宜的加热方式为_____ 。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_____ 。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是_____ 。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
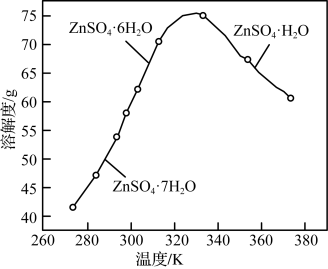
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4•H2O的实验、操作为_____ 。
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+.为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的_____ (填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21.测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15g•L﹣1、0.58g•L﹣1,可采用“氧化中和共沉淀”法除去,请设计实验方案:_____ (实验中须使用的试剂有:30%双氧水,0.001mol•L﹣1K3[Fe(CN)6]溶液,回收的铜锌沉淀物)。

已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85℃条件下进行,适宜的加热方式为
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
| NaOH浓度/mol•L﹣1 | 脱氯率/% | 元素浸出率/% | ||
| Cl | Zn | Cu | As | |
| 1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
| 2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
| 3.0 | 86.58 | 7.39 | 0.26 | 78.22 |

(4)滤液1和滤液2中含一定量的Cu2+、Zn2+.为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21.测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15g•L﹣1、0.58g•L﹣1,可采用“氧化中和共沉淀”法除去,请设计实验方案:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网