单选题 适中0.65 引用4 组卷330
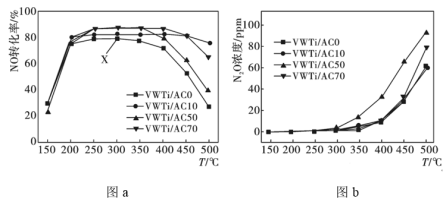
在恒容、NH3和NO的起始浓度一定的条件下,分别以VWTi/AC0、VWTi/AC10、VWTi/AC50、VWTi/AC70为催化剂,发生反应:4NH3(g)+6NO(g) 5N2(g)+6H2O(g)△H<0,相同时间内测得不同温度下NO转化为N2的转化率如图a所示,温度升高有副产物N2O生成,测得不同温度N2O的生成量如图b所示。下列说法正确的是
5N2(g)+6H2O(g)△H<0,相同时间内测得不同温度下NO转化为N2的转化率如图a所示,温度升高有副产物N2O生成,测得不同温度N2O的生成量如图b所示。下列说法正确的是
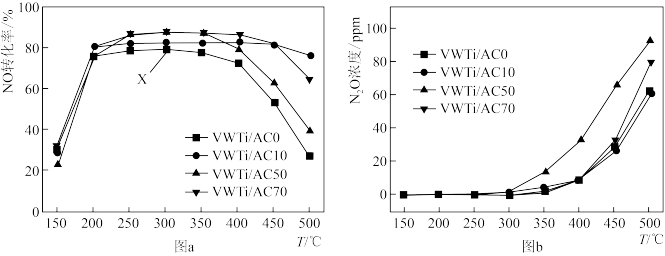

| A.VWTi/AC50在T>350℃之后NO转化率降低的可能原因是有副反应的发生 |
| B.以VWTi/AC0为催化剂,温度高于400℃后曲线上的任一点均是对应温度下的平衡点 |
| C.图中X点所示条件下,增加NH3浓度不能提高NO转化率 |
| D.250℃时K=1024,若起始时充入c(NH3)=c(NO)=c(N2)=1mol·L-1,c(H2O)=2mol·L-1,则v正<v逆 |
2022·湖南衡阳·模拟预测
类题推荐
利用CO或CO2和H2反应都可以制取甲醇。
(1)已知:CO2(g)+H2(g)⇌CO(g)+2H2O(g) ΔH1=+41kJ·mol-1
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2=-49kJ·mol-1
则反应CO(g)+2H2(g)⇌CH3OH(g) ΔH=_______ 。可以在_______ 进行(填序号)。
A.高温自发 B.低温自发 C.高、低温均能自发 D.高、低温均不自发
(2)利用反应CO(g)+2H2(g)⇌CH3OH(g)ΔH合成甲醇。T°C时向固定容积的密闭容器中充入CO、H2,反应到t时刻测得各组分的浓度如下:
①如果该反应的平衡常数K=160,比较t时刻正、逆反应速率的大小:v正_______ v逆(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_______ (填序号)。
A.加入催化剂 B.增大CO的浓度 C.通入惰性气体 D.通入H2 E.分离出甲醇
(3)T℃时,向恒容密闭容器中充入CO2和H2,发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H。
①如果CO2和H2的起始浓度分别为amol·L-1和3amol·L-1,反应平衡时CH3OH的产率为b,则该温度下该反应的平衡常数K=_______ (用含a、b的表达式表示)。
②在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如下图所示。
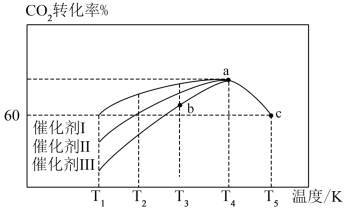
则催化效果最佳的是催化剂_______ (填“I”、“II”或“III”)。如果a点已经达到平衡状态,则b点的v正_______ v逆(填“>”、“<”或“=”),c点转化率比a点低的原因是_______ 。
(1)已知:CO2(g)+H2(g)⇌CO(g)+2H2O(g) ΔH1=+41kJ·mol-1
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2=-49kJ·mol-1
则反应CO(g)+2H2(g)⇌CH3OH(g) ΔH=
A.高温自发 B.低温自发 C.高、低温均能自发 D.高、低温均不自发
(2)利用反应CO(g)+2H2(g)⇌CH3OH(g)ΔH合成甲醇。T°C时向固定容积的密闭容器中充入CO、H2,反应到t时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/mol·L-1 | 0.20 | 0.10 | 0.40 |
②要提高CO的转化率,可以采取的措施是
A.加入催化剂 B.增大CO的浓度 C.通入惰性气体 D.通入H2 E.分离出甲醇
(3)T℃时,向恒容密闭容器中充入CO2和H2,发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H。
①如果CO2和H2的起始浓度分别为amol·L-1和3amol·L-1,反应平衡时CH3OH的产率为b,则该温度下该反应的平衡常数K=
②在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如下图所示。

则催化效果最佳的是催化剂
氮的化合物在生产、生活中有广泛应用。
(1)已知几种共价键的键能数据如下表所示:
根据表格数据,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=___________ kJ∙mol-1。
(2)向一恒温恒容密闭容器中充入一定量N2O4和N2H4,发生反应: 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H<0。下列说法正确的是___________ (填标号)。
A.当气体平均摩尔质量不随时间变化时,达到平衡状态
B.平衡后,充入惰性气体,平衡向右移动
C.上述反应的正反应活化能大于逆反应活化能
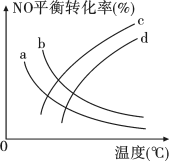
(3)工业上,采用NH3还原NO法消除NO污染。一定条件下,向一恒容密闭容器中充入NH3和NO,在不同催化剂Catl、Cat2、Cat3作用下发生反应: 4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0。测得相同时间内NO的转化率随温度的变化如图1所示。
①a点时:v正(NO)___________ (填“>”、“<”或“=”) v逆(NO)。
②bc段NO的转化率随温度升高而降低,可能的原因是___________ 。(任答一点)


(4)工业上用天然气处理NO2,消除NO2的污染。发生的反应为CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g)。在一定温度下,向一恒容密闭容器中充入1molCH4和2mol NO2,发生上述反应,起始时测得总压强为90kPa。N2的分压与时间的关系如图2所示。
CO2(g)+2H2O(g)+N2(g)。在一定温度下,向一恒容密闭容器中充入1molCH4和2mol NO2,发生上述反应,起始时测得总压强为90kPa。N2的分压与时间的关系如图2所示。
①0~10min内NO2的分压变化速率为___________ kPa∙min-1。
②该温度下,平衡常数Kp=___________ kPa。(提示:用气体分压计算的平衡常数为Kp,气体分压=总压×物质的量分数)
(5)工业上制备HCN的反应为CH4(g)+NH3(g) HCN(g)+3H2(g) △H>0。速率方程为
HCN(g)+3H2(g) △H>0。速率方程为 ,
, ( k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。
( k正、k逆分别为正、逆反应速率常数,只与温度、催化剂有关)。
①其他条件不变,反应达到平衡后,NH3的转化率随着条件X的增大而增大,则X可能是___________ 。(答一种即可)
②升高温度,k逆增大的倍数___________ k正增大的倍数(填“>”、“<”或“=”)
(1)已知几种共价键的键能数据如下表所示:
| 共价键 | |||||
| 键能/ kJ∙mol-1 | 391 | 160 | 945 | 498 | 467 |
(2)向一恒温恒容密闭容器中充入一定量N2O4和N2H4,发生反应: 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H<0。下列说法正确的是
A.当气体平均摩尔质量不随时间变化时,达到平衡状态
B.平衡后,充入惰性气体,平衡向右移动
C.上述反应的正反应活化能大于逆反应活化能
(3)工业上,采用NH3还原NO法消除NO污染。一定条件下,向一恒容密闭容器中充入NH3和NO,在不同催化剂Catl、Cat2、Cat3作用下发生反应: 4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0。测得相同时间内NO的转化率随温度的变化如图1所示。
①a点时:v正(NO)
②bc段NO的转化率随温度升高而降低,可能的原因是


(4)工业上用天然气处理NO2,消除NO2的污染。发生的反应为CH4(g)+2NO2(g)
①0~10min内NO2的分压变化速率为
②该温度下,平衡常数Kp=
(5)工业上制备HCN的反应为CH4(g)+NH3(g)
①其他条件不变,反应达到平衡后,NH3的转化率随着条件X的增大而增大,则X可能是
②升高温度,k逆增大的倍数
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网