解答题-原理综合题 适中0.65 引用1 组卷133
阅读题目,回答问题:
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为____ ,若将此反应设计成原电池,请写出该原电池负极电极反应为____ ,正极电极反应为____ 。
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为_____ 。
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作____ 剂。
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
填写表中空白内容:II____ ,III____ ,IV____ 。
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极____ (填“a”或“b”),负极发生反应的方程式为____ 。
②电池工作时,溶液中的K+会向____ 区移动(填“正极”或“负极”),当外电路中转移1mol电子时,消耗的O2在标准状况下体积为____ 。
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
| 试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/mL | FeCl3溶液体积/mL | |
| 质量分数 | 体积/mL | |||||
| I | 为编号II实验的参照 | 12% | 5.0 | 常温 | 0 | 0 |
| II | 温度对反应速率的影响 | —— | 5.0 | 60℃ | 0 | 0 |
| III | 为编号IV实验的参照 | 4.0% | 5.0 | 常温 | —— | 0 |
| IV | —— | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中空白内容:II
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极
②电池工作时,溶液中的K+会向
21-22高一下·广东广州·期中
类题推荐
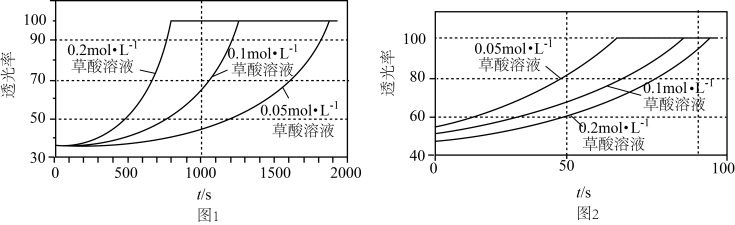
某研究小组为了验证反应物浓度对反应速率的影响,在室温下向2mL0.001mol·L-1KMnO4溶液中分别加入不同浓度的草酸溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001mol·L-1KMnO4溶液,实验结果如图2。回答有关问题:
已知:草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同) Mn(VI)
Mn(VI) Mn(IV)
Mn(IV) Mn(III)
Mn(III) Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
(1)实验时发生总反应的离子方程式为___ 。
(2)由题可知,Mn(II)的作用是___ ;由图2可知,在当前实验条件下,增大草酸的浓度,褪色时间___ (填“变大”、“变小”或“不变”)。
(3)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
①请完成此实验设计:V5=___ ,V6=___ 。
②设计A号试管实验的目的是___ 。
(4)已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5。
①写出H2C2O4与少量的KOH溶液反应的离子方程式:___ 。
②已知25℃时CH3COOH的电离常数为K=1.75×10-5,则等浓度的草酸溶液和醋酸溶液中,pH较小的是___ 。

已知:草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同)
(1)实验时发生总反应的离子方程式为
(2)由题可知,Mn(II)的作用是
(3)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
| 试管编号 | 0.01mol•L-1KMnO4溶液/mL | 0.2mol•L-1 H2C2O4溶液/mL | 蒸馏水/mL | 2.0mol•L-1H2SO4溶液/mL |
| A | 4.0 | 2.0 | 2.0 | 0 |
| B | V1 | V2 | 1.5 | V3 |
| C | V4 | 2.0 | V5 | 1.0 |
| D | V6 | 2.0 | 0 | 2.0 |
①请完成此实验设计:V5=
②设计A号试管实验的目的是
(4)已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5。
①写出H2C2O4与少量的KOH溶液反应的离子方程式:
②已知25℃时CH3COOH的电离常数为K=1.75×10-5,则等浓度的草酸溶液和醋酸溶液中,pH较小的是
(i)在2L密闭容器中,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:
(1)如图中A点处,v(正)_______ v(逆)(填“大于”“小于”或“等于”,下同),A点正反应速率_______ B点正反应速率
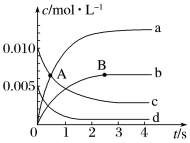
(2)图中表示NO2的变化的曲线是_______ ,用O2表示从0~2s内该反应的平均速率v=_______ 。
(3)能使该反应的反应速率增大的是_______ 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
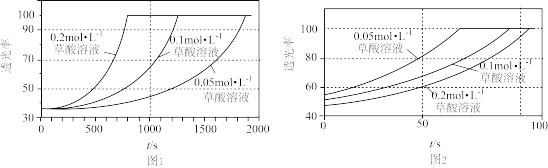
(ii)某研究小组为了验证反应物浓度对反应速率的影响,在室温下向2mL0.001mol·L-1KMnO4溶液中分别加入不同浓度的草酸(H2C2O4)溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001mol·L-1KMnO4溶液,实验结果如图2。回答有关问题:
已知:i.草酸为二元弱酸
ii.草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同) Mn(VI)
Mn(VI) Mn(IV)
Mn(IV) Mn(III)
Mn(III) [Mn(III)(C2O4)n]3-2n(红色)→Mn(II)+2nCO2
[Mn(III)(C2O4)n]3-2n(红色)→Mn(II)+2nCO2
(4)实验时发生总反应的离子方程式为_______ 。
(5)由题可知,Mn(II)的作用是_______ ;由图2可知,在当前实验条件下,增大草酸的浓度,褪色时间_______ (填“变大”、“变小”或“不变”)。
(6)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
①请完成此实验设计:V5=_______ ,V6=_______ 。
②设计A号试管实验的目的是_______ 。
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(2)图中表示NO2的变化的曲线是
(3)能使该反应的反应速率增大的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(ii)某研究小组为了验证反应物浓度对反应速率的影响,在室温下向2mL0.001mol·L-1KMnO4溶液中分别加入不同浓度的草酸(H2C2O4)溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001mol·L-1KMnO4溶液,实验结果如图2。回答有关问题:

已知:i.草酸为二元弱酸
ii.草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同)
(4)实验时发生总反应的离子方程式为
(5)由题可知,Mn(II)的作用是
(6)对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):
| 试管编号 | 0.01mol•L-1KMnO4溶液/mL | 0.2mol•L-1H2C2O4溶液/mL | 蒸馏水/mL | 2.0mol•L-1H2SO4溶液/mL |
| A | 4.0 | 2.0 | 2.0 | 0 |
| B | V1 | V2 | 1.5 | V3 |
| C | V4 | 2.0 | V5 | 1.0 |
| D | V6 | 2.0 | 0 | 2.0 |
②设计A号试管实验的目的是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网