解答题-实验探究题 适中0.65 引用1 组卷196
某兴趣小组用L-乳酸钙制备L-乳酸亚铁晶体,流程如下:

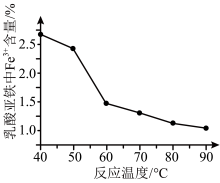
已知: Fe3+对产品的品质有较大的影响,相关实验结果图示如下:

请回答:
(1)步骤II中反应时间控制在30min,不能过长也不能过短,原因是___________ 。
(2)下列说法不正确的是___________
A.步骤I,反应中控制温度的方法可以采用恒温水浴加热
B.反应温度65-70°C时,产品的收率高,生成的结晶颗粒较大,固液分离较为完全,产品中夹杂的Fe3+含量减少。
C.步骤II,反应应在密闭容器或通氮条件下进行,以减少空气对亚铁盐的氧化
D.步骤III中,为析出颗粒比较大晶体,可采用冰水冷却
E.步骤V,将滤液蒸发、浓缩、过滤、结晶可得副产物CaCl2
(3)对于步骤IV:
①洗涤剂可通过蒸馏实现循环利用。如图是蒸馏装置示意图,其中分馏柱分馏柱的作用是___________ 。

②在干燥前,为得到纯度较高的L-乳酸亚铁晶体,需要对粗产品进行洗涤,请从下列选项中选出合理的操作(操作不能重复使用) 并排序:___________
粗产品放入烧杯中→( )→( )→ ( )→( )→低温真空干燥
a.加入适量的冷水
b.加入适量的65°C- 70°C的水
c.加入80% -85%的乙醇溶液。
d.静置使产品充分沉降
e.将烧杯中的上层清液沿玻璃棒倒入另一只烧杯中
f.用玻璃棒充分搅拌
(4)实验室可用电位滴定法测定L-乳酸亚铁中的Fe2+含量。在被测溶液中插入一个指示电极和一个参比电极组成一个工作电池,当用酸性高锰酸钾标准溶液滴定乳酸亚铁溶液时,Fe2+浓度不断变化,指示电极的电位相应变化,根据测量工作电池电动势的变化就可确定终点。用E表示指示电极的电位,V表示标准溶液体积,△E表示指示电极的电位改变量,△V表示标准溶液体积增量,以下滴定过程中所示图象正确的是
(5)某研究小组用KMnO4滴定法测定样品中乳酸亚铁含量进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是___________

已知: Fe3+对产品的品质有较大的影响,相关实验结果图示如下:

请回答:
(1)步骤II中反应时间控制在30min,不能过长也不能过短,原因是
(2)下列说法不正确的是
A.步骤I,反应中控制温度的方法可以采用恒温水浴加热
B.反应温度65-70°C时,产品的收率高,生成的结晶颗粒较大,固液分离较为完全,产品中夹杂的Fe3+含量减少。
C.步骤II,反应应在密闭容器或通氮条件下进行,以减少空气对亚铁盐的氧化
D.步骤III中,为析出颗粒比较大晶体,可采用冰水冷却
E.步骤V,将滤液蒸发、浓缩、过滤、结晶可得副产物CaCl2
(3)对于步骤IV:
①洗涤剂可通过蒸馏实现循环利用。如图是蒸馏装置示意图,其中分馏柱分馏柱的作用是

②在干燥前,为得到纯度较高的L-乳酸亚铁晶体,需要对粗产品进行洗涤,请从下列选项中选出合理的操作(操作不能重复使用) 并排序:
粗产品放入烧杯中→( )→( )→ ( )→( )→低温真空干燥
a.加入适量的冷水
b.加入适量的65°C- 70°C的水
c.加入80% -85%的乙醇溶液。
d.静置使产品充分沉降
e.将烧杯中的上层清液沿玻璃棒倒入另一只烧杯中
f.用玻璃棒充分搅拌
(4)实验室可用电位滴定法测定L-乳酸亚铁中的Fe2+含量。在被测溶液中插入一个指示电极和一个参比电极组成一个工作电池,当用酸性高锰酸钾标准溶液滴定乳酸亚铁溶液时,Fe2+浓度不断变化,指示电极的电位相应变化,根据测量工作电池电动势的变化就可确定终点。用E表示指示电极的电位,V表示标准溶液体积,△E表示指示电极的电位改变量,△V表示标准溶液体积增量,以下滴定过程中所示图象正确的是
A. | B. |
C. | D. |
20-21高三下·浙江绍兴·阶段练习
类题推荐
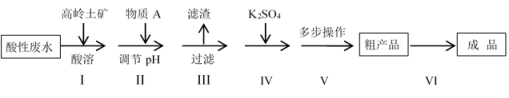
高岭土矿的主要成分是Al2O3、SiO2及少量的Fe2O3,高岭土选矿酸性废水含有大量的H+、SO 、Al3+及少量的Fe3+等离子。工业上利用高岭土矿和酸性废水制备明矾KAl(SO4)2•12H2O(不考虑其它杂质参与反应)。其实验流程如下:
、Al3+及少量的Fe3+等离子。工业上利用高岭土矿和酸性废水制备明矾KAl(SO4)2•12H2O(不考虑其它杂质参与反应)。其实验流程如下:
相关信息:
①Fe3+、Al3+完全沉淀的pH范围
②有关物质的溶解度
请回答:
(1)步骤I中,要加快高岭土酸溶的速率可以采取的措施有___________ 。(至少写两点),
(2)滤渣的主要成分是___________ 。
(3)下列说法中正确的是___________ 。
A.步骤I的主要目的是提高废水中铝离子的浓度
B.步骤II中的A物质可以是KOH或NaOH
C.步骤II中调节pH的范围是3.2<pH<3.4
D.步骤IV中需调控K2SO4的用量,使n(Al3+):n(K+):n(SO )尽可能接近1:1:2
)尽可能接近1:1:2
(4)步骤VI,为了得到较大颗粒且较干燥的晶体,请从下列选项中选出合理的操作(操作不重复)并排序:取粗产品于烧杯中加适量水→___________→___________→___________→抽滤→洗涤→___________。___________
a.70℃蒸发溶剂制成热的饱和溶液 b.30℃~40℃减压蒸发溶剂得到饱和溶液
c.加热烧杯至晶体完全溶解 d.缓慢冷却至室温 e.低温干燥 f.加热干燥
(5)为了测定成品中铝的含量,可采用的方法:将一定体积的成品待测液与过量的EDTA(化学式为Na2H2Y)标准液反应,加入几滴指示剂,再用ZnSO4标准液滴定过量的EDTA,反应原理如下:Al3++H2Y2-(过量)=AlY-+2H+、Zn2++H2Y2-(剩余)=ZnY2-+2H+(终点色为紫红色),过实验测出成品中铝的含量低于理论值,原因可能是___________ 。
A.制备过程中,由于结晶温度控制不当,溶液中硫酸钾晶体同时析出
B.酸式滴定管用蒸馏水洗净后就注入ZnSO4标准液
C.滴定时锥形瓶溶液出现紫红色,立即停止滴定
D.滴定前,滴定管内无气泡,滴定后有气泡

相关信息:
①Fe3+、Al3+完全沉淀的pH范围
| 沉淀 | Fe(OH)3 | Al(OH)3 | ||
| pH范围 | 开始沉淀 | 完全沉淀 | 开始沉淀 | 完全沉淀 |
| 2.0 | 3.2 | 3.4 | 4.7 | |
| 温度/℃ 溶解度/g 物质 | 10 | 20 | 30 | 40 | 50 | 70 |
| K2SO4 | 8.46 | 9.55 | 11.4 | 12.9 | 14.2 | 16.7 |
| Al2(SO4)3 | 25.1 | 26.6 | 28.8 | 31.4 | 34.3 | 42.2 |
| KAl(SO4)2•12H2O | 4.0 | 5.9 | 8.4 | 11.7 | 17 | 40 |
(1)步骤I中,要加快高岭土酸溶的速率可以采取的措施有
(2)滤渣的主要成分是
(3)下列说法中正确的是
A.步骤I的主要目的是提高废水中铝离子的浓度
B.步骤II中的A物质可以是KOH或NaOH
C.步骤II中调节pH的范围是3.2<pH<3.4
D.步骤IV中需调控K2SO4的用量,使n(Al3+):n(K+):n(SO
(4)步骤VI,为了得到较大颗粒且较干燥的晶体,请从下列选项中选出合理的操作(操作不重复)并排序:取粗产品于烧杯中加适量水→___________→___________→___________→抽滤→洗涤→___________。
a.70℃蒸发溶剂制成热的饱和溶液 b.30℃~40℃减压蒸发溶剂得到饱和溶液
c.加热烧杯至晶体完全溶解 d.缓慢冷却至室温 e.低温干燥 f.加热干燥
(5)为了测定成品中铝的含量,可采用的方法:将一定体积的成品待测液与过量的EDTA(化学式为Na2H2Y)标准液反应,加入几滴指示剂,再用ZnSO4标准液滴定过量的EDTA,反应原理如下:Al3++H2Y2-(过量)=AlY-+2H+、Zn2++H2Y2-(剩余)=ZnY2-+2H+(终点色为紫红色),过实验测出成品中铝的含量低于理论值,原因可能是
A.制备过程中,由于结晶温度控制不当,溶液中硫酸钾晶体同时析出
B.酸式滴定管用蒸馏水洗净后就注入ZnSO4标准液
C.滴定时锥形瓶溶液出现紫红色,立即停止滴定
D.滴定前,滴定管内无气泡,滴定后有气泡
高纯六水氯化锶(SrCl2·6H2O)可用于制药工业和日用化工,可以用含锶废渣进行制备,含锶废渣主要成分为SrCO3,且含钡、铁等杂质,下面为实验室模拟SrCl2·6H2O的制作流程:
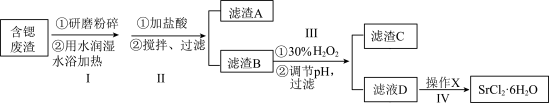
已知:①步骤Ⅱ硫酸加入的量和溶液中Ba2+和Sr2+含量的关系如下表所示:
②SrCl2·6H2O在61.5°C以上即会失去结晶水生成二水氯化锶结晶。
(1)步骤Ⅰ和Ⅱ中研磨粉碎、搅拌的目的是____________
(2)在步骤Ⅱ中,加入硫酸量过量20%较合适,请解释原因___________
(3)下列说法正确的是________
(4)已知:加入晶种可以促使晶体析出,结晶速度越慢越易得到大颗粒晶体,在操作Ⅳ中,若要从滤液D通过操作X得到较大颗粒的高纯六水氯化锶晶体,操作X包含下列步骤中的某几项,请排序。(填相应步骤的字母)
滤液D→______ →b→_______ →过滤→______ →f
a.蒸发浓缩至有大量晶体析出 b.加入晶种
c.61.5°C以上减压蒸发浓缩至饱和 d.61.5℃以下减压蒸发浓缩至饱和
e.用乙醇润洗晶体 f.在30℃真空烘箱中进行干燥
g. 冷却结晶
(5)为测产品纯度,取1.70 g实验制得的产物(SrCl2·6H2O的相对分子量为266.6),加水溶解,配成100 mL溶液,用移液管取出25 mL于锥形瓶中,滴入几滴K2CrO4,用浓度为0.100 mol/L的硝酸银标准溶液滴定,重复滴定三次测得硝酸银标准溶液用量分别为19.98 mL、18.00 mL、20.02 mL。已知: 为砖红色沉淀,
为砖红色沉淀, ,
, 。下列说法正确的是
。下列说法正确的是_______ 。
A. 当锥形瓶中出现砖红色沉淀时,说明已到达滴定终点
B. 平均用去硝酸银标准溶液为19.33 mL
C. 滴定终点时仰视读数会使测定结果偏低
D. 滴定前锥形瓶中有水对滴定结果无影响
E. 通过测定,产品纯度为62.7%

已知:①步骤Ⅱ硫酸加入的量和溶液中Ba2+和Sr2+含量的关系如下表所示:
| 硫酸加入量/mL | 4.5 | 4.95 | 5.4 | 5.85 | 6.3 |
| Ba2+/(g/L) | 0.37 | 0.21 | 0.13 | 0.11 | 0.10 |
| Sr2+/(g/L) | 90.21 | 89.86 | 89.57 | 89.23 | 88.90 |
(1)步骤Ⅰ和Ⅱ中研磨粉碎、搅拌的目的是
(2)在步骤Ⅱ中,加入硫酸量过量20%较合适,请解释原因
(3)下列说法正确的是________
| A.步骤Ⅰ若要控制反应温度在80℃,可以采用水浴加热 |
| B.滤渣A中只含有BaSO4 |
| C.H2O2的作用是将Fe2+氧化为Fe3+,滤渣C主要成分为Fe(OH)3 |
| D.操作X需要控制温度在61.5℃以下,防止晶体失去结晶水 |
滤液D→
a.蒸发浓缩至有大量晶体析出 b.加入晶种
c.61.5°C以上减压蒸发浓缩至饱和 d.61.5℃以下减压蒸发浓缩至饱和
e.用乙醇润洗晶体 f.在30℃真空烘箱中进行干燥
g. 冷却结晶
(5)为测产品纯度,取1.70 g实验制得的产物(SrCl2·6H2O的相对分子量为266.6),加水溶解,配成100 mL溶液,用移液管取出25 mL于锥形瓶中,滴入几滴K2CrO4,用浓度为0.100 mol/L的硝酸银标准溶液滴定,重复滴定三次测得硝酸银标准溶液用量分别为19.98 mL、18.00 mL、20.02 mL。已知:
A. 当锥形瓶中出现砖红色沉淀时,说明已到达滴定终点
B. 平均用去硝酸银标准溶液为19.33 mL
C. 滴定终点时仰视读数会使测定结果偏低
D. 滴定前锥形瓶中有水对滴定结果无影响
E. 通过测定,产品纯度为62.7%
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
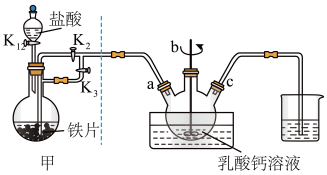
 按图示要求加入试剂
按图示要求加入试剂