解答题-实验探究题 适中0.65 引用1 组卷181
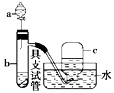
铜和稀硝酸在无氧环境下会生成弱酸 。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。
。某实验小组为探究铜和稀硝酸的反应,设计实验装置如图。

实验过程现象记录如下表。
(1)仪器a的名称为_______ 。
(2)滴入硝酸前,为营造无氧环境,应进行的操作是_______ 。
(3)反应过程中产生的 会进一步与Cu反应生成NO,其离子方程式为
会进一步与Cu反应生成NO,其离子方程式为_______ 。
(4)溶液呈绿色是 和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:
和体系中某种微粒相互作用的结果,为探究该微粒进行下列实验:
根据以上实验现象可知, 和
和_______ (填化学式)相互作用达到平衡呈绿色。
(5)取适量150 min时反应液于试管中,加入_______ ,溶液由蓝色变为绿色,,说明150 min时反应液中含有 。
。
(6)结合平衡移动原理解释150~300 min反应液颜色变化的原因_______ 。
(7)基于上述装置,选择合适试剂,设计实验证明 对Cu与
对Cu与 硝酸的反应具有催化作用
硝酸的反应具有催化作用_______ (简述实验方案及观测指标)。

实验过程现象记录如下表。
| 时间/min | 0~75 | 75~150 | 150~225 | 225~300 | 300~375 |
| 溶液颜色 | 接近无色 | 无色→浅蓝色 | 浅蓝色→绿色 | 绿色→深蓝色 | 浅蓝色 |
| 生成NO体积/mL | 0 | 1.0 | 42.0 | 137.5 | 0.5 |
| 反应体系温度/℃ | 26.6 | 26.8 | 26.8~27.2 | 27.2~28.8 | 28.8~28.6 |
(2)滴入硝酸前,为营造无氧环境,应进行的操作是
(3)反应过程中产生的
(4)溶液呈绿色是
| 序号 | 实验操作 | 现象 |
| a | 往 | 溶液始终为蓝色 |
| b | 往 | 溶液变为绿色 |
| c | 往 | 溶液先变为绿色后逐渐变为蓝色 |
(5)取适量150 min时反应液于试管中,加入
(6)结合平衡移动原理解释150~300 min反应液颜色变化的原因
(7)基于上述装置,选择合适试剂,设计实验证明
21-22高三·福建厦门·阶段练习
类题推荐
某学习小组探究铜与稀硝酸反应速率变化时,将3.2g铜丝装入注射器(无氧环境)中,再抽取25mL1.35mol·L-1稀硝酸。实验现象:反应开始阶段无明显现象,90min左右才有很少气泡产生,150min左右体系溶液为浅蓝色(反应较慢阶段A),之后逐渐变为绿色(反应较快阶段B),最终溶液呈深蓝色(阶段C)。
(1)铜与稀硝酸反应的离子方程式为____ 。
(2)室温26.6℃,反应过程中最高温度27.8℃;在45℃水浴中重复实验,反应现象变化不大,说明____ 。
(3)为探究铜与1.35mol·L-1稀硝酸在无氧条件下显绿色的原因,分别取A、B、C阶段溶液进行实验。实验操作和现象如表:
查阅资料表明,硝酸在反应过程中首先生成HNO2,已知HNO2是弱酸(电离方程式HNO2 H++NO
H++NO ),遇微热即分解成NO和NO2,NO
),遇微热即分解成NO和NO2,NO 可与Cu2+生成绿色络合离子Cu(NO2)
可与Cu2+生成绿色络合离子Cu(NO2) 。
。
①分析可知溶液中颜色浅蓝→绿→深蓝的原因:反应开始时溶液中c(H+)较大,c(Cu2+)较小,溶液呈浅蓝色;
②反应进行过程中,____ ,且c(Cu2+)增大,与NO 结合生成Cu(NO2)
结合生成Cu(NO2) ,溶液呈绿色;(用平衡移动原理解释)
,溶液呈绿色;(用平衡移动原理解释)
③最后由于____ ,c(NO )减小,c[Cu(NO2)
)减小,c[Cu(NO2) ]减小,而c(Cu2+)较大,溶液呈深蓝色。
]减小,而c(Cu2+)较大,溶液呈深蓝色。
(4)在反应体系温度几乎不变的情况下,反应速率先慢后快,推测反应过程中有催化剂生成,并推测HNO2或NO 是催化剂,请设计实验验证推测:
是催化剂,请设计实验验证推测:____ 。(可供选择的试剂:铜丝、2mol·L-1硝酸、1.35mol·L-1硝酸、NaNO2固体)
(5)可推测反应分为三步进行:Cu+3HNO3=Cu(NO3)2+HNO2+H2O、2HNO2=NO+NO2+H2O和____ 。
(1)铜与稀硝酸反应的离子方程式为
(2)室温26.6℃,反应过程中最高温度27.8℃;在45℃水浴中重复实验,反应现象变化不大,说明
(3)为探究铜与1.35mol·L-1稀硝酸在无氧条件下显绿色的原因,分别取A、B、C阶段溶液进行实验。实验操作和现象如表:
| 序号 | 实验内容 | A溶液(浅蓝色) | B溶液(绿色) | C溶液(深蓝色) |
| 1 | 滴加0.001mol·L-1KMnO4溶液 | 褪色,滴入5~6滴后不再褪色 | 褪色,但滴入20滴后仍褪色 | 褪色,滴入10滴后不再褪色 |
| 2 | 加热较长时间后再滴加0.001mol·L-1KMnO4溶液 | 不褪色 | 不褪色 | 不褪色 |
| 3 | 逐滴滴加稀硫酸 | 无明显现象 | 变蓝色 | 无明显现象 |
| 4 | 逐滴滴加NaOH溶液 | 变浅绿色 | 无明显现象 | 变浅绿色 |
①分析可知溶液中颜色浅蓝→绿→深蓝的原因:反应开始时溶液中c(H+)较大,c(Cu2+)较小,溶液呈浅蓝色;
②反应进行过程中,
③最后由于
(4)在反应体系温度几乎不变的情况下,反应速率先慢后快,推测反应过程中有催化剂生成,并推测HNO2或NO
(5)可推测反应分为三步进行:Cu+3HNO3=Cu(NO3)2+HNO2+H2O、2HNO2=NO+NO2+H2O和
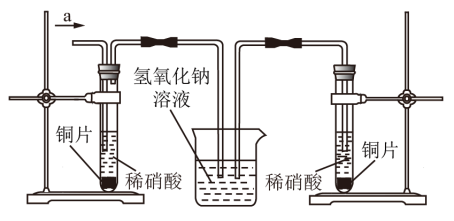
某兴趣小组在利用图所示装置做铜与稀硝酸反应的实验中,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。
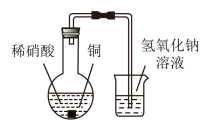
(1)图中铜与稀硝酸反应的离子方程式为___________ 。
(2)图中NaOH溶液能够吸收的有害气体是___________ 。
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
结合实验目的和表中数据,你得出的结论是___________ 。
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的___________ (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
III.丙同学根据现象推测反应过程中还有少量______ 生成,进而认为该物质对反应有催化作用,如图所示,丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)

(1)图中铜与稀硝酸反应的离子方程式为
(2)图中NaOH溶液能够吸收的有害气体是
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
III.丙同学根据现象推测反应过程中还有少量

(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)
| 操作 | 现象 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网