解答题-实验探究题 0.4 引用3 组卷594
氯化亚铜(CuCl)是一种非常重要的化工原料。查阅资料可知:CuCl为白色固体,微溶于水,不溶于乙醇,在空气中能被迅速氧化。回答下列问题:
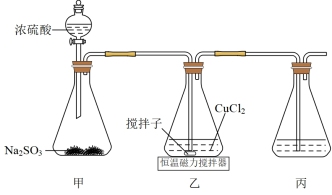
I.氯化亚铜的制备
方案一:SO2还原氯化铜制备CuCl。
(1)装置乙中发生反应的离子方程式为_______ 。反应完成后将乙中混合物过滤、洗涤、干燥。“过滤”操作最好选用下列装置中的_______ (填字母),“洗涤”时用乙醇代替蒸馏水的优点是_______ 。
方案二:高温加热分解氯化铜晶体(CuCl2·xH2O)制备CuCl,装置如图(加热及夹持仪器省略)。
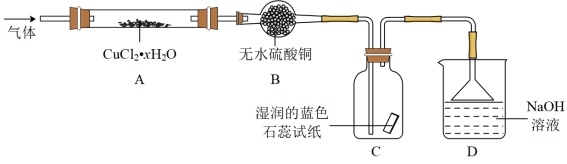
(2)检查装置气密性后加入药品,通入干燥HCl,加热,观察到B中固体由白色变为蓝色,C中试纸的颜色变化为_______ 。停止加热,冷却后改通N2.实验中通入HCl的目的是_______ 。
Ⅱ.产品纯度的测定
(3)准确称取氯化亚铜产品mg,溶于过量的FeCl3溶液中得V1mL待测液,从中量取V2mL于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用amol·L-l硫酸铈[Ce(SO4)2]标准溶液滴定至终点,消耗Ce(SO4)2溶液bmL。产品中CuCl的质量分数为_______ %。
(已知:CuCl+Fe3+=Cu2++Fe2++Cl-,Fe2++Ce4+=Fe3++Ce3+)
下列有关滴定的说法错误的是_______ (填字母)。
A.未用标准溶液润洗滴定管会使测定结果偏低
B.滴定时要适当控制滴定速度
C.在接近终点时,使用“半滴操作”可提高滴定的准确度
D.滴定前滴定管尖嘴部分有气泡,滴定后无气泡会使测定结果偏低

I.氯化亚铜的制备
方案一:SO2还原氯化铜制备CuCl。
(1)装置乙中发生反应的离子方程式为

方案二:高温加热分解氯化铜晶体(CuCl2·xH2O)制备CuCl,装置如图(加热及夹持仪器省略)。

(2)检查装置气密性后加入药品,通入干燥HCl,加热,观察到B中固体由白色变为蓝色,C中试纸的颜色变化为
Ⅱ.产品纯度的测定
(3)准确称取氯化亚铜产品mg,溶于过量的FeCl3溶液中得V1mL待测液,从中量取V2mL于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用amol·L-l硫酸铈[Ce(SO4)2]标准溶液滴定至终点,消耗Ce(SO4)2溶液bmL。产品中CuCl的质量分数为
(已知:CuCl+Fe3+=Cu2++Fe2++Cl-,Fe2++Ce4+=Fe3++Ce3+)
下列有关滴定的说法错误的是
A.未用标准溶液润洗滴定管会使测定结果偏低
B.滴定时要适当控制滴定速度
C.在接近终点时,使用“半滴操作”可提高滴定的准确度
D.滴定前滴定管尖嘴部分有气泡,滴定后无气泡会使测定结果偏低
2022·山东滨州·二模


