单选题 适中0.65 引用2 组卷305
某小组探究FeCl3和Na2S竟色反应。
【查阅资料】
①硫单质微溶于乙醇,难溶于水;
②FeS、Fe2S3均为黑色固体,难溶于水:
③Fe3++6F-=[FeF6]3-,[FeF6]3-为无色离子。
【设计实验】
下列推断正确的是
【查阅资料】
①硫单质微溶于乙醇,难溶于水;
②FeS、Fe2S3均为黑色固体,难溶于水:
③Fe3++6F-=[FeF6]3-,[FeF6]3-为无色离子。
【设计实验】
| 序号 | I | II | III |
| 操作 | 在1mL0.1mol·L-1Na2S溶液中加入1mL0.1mol·L-1FeCl3溶液 | 在1.5mL0.1mol·L-1 | 在2mLlmol·L-1NaF溶液中加入0.5mL0.1mol·L-1FeCl3溶液,得无色溶液,再加入1.5mL0.1mol·L-1Na2S溶液 |
| 现象 | 迅速产生黑色沉淀X,振荡,黑色沉淀溶解,放出臭鸡蛋气味气体,最终得到棕黄色浊液Y | 产生棕黑色沉淀Z | 产生黑色沉淀W |
| 结论 | 分离Y得到Fe(OH)3和S | 经检验,Z的主要成分是Fe2S3,含少量Fe(OH)3 | 经检验,W为Fe2S3 |
| A.黑色沉淀X溶解只发生复分解反应 |
| B.实验II不生成S可能是氧化还原速率较大 |
| C.生成黑色沉淀W的反应为2Fe3++3S2-=Fe2S3↓ |
| D.反应物中 |
2022·湖南·模拟预测
类题推荐
某小组探究 的制备。配制0.1
的制备。配制0.1 的
的 溶液和0.1
溶液和0.1 的
的 溶液备用。
溶液备用。
【查阅资料】
i.FeS、 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。
ii. ,
, 为无色离子。
为无色离子。
iii.硫单质微溶于乙醇,难溶于水。
【设计并实施实验】
(1)实验一中,根据复分解反应规律推测,生产黑色沉淀a的离子方程式为_______ 。
(2)进一步检验浊液X的组成,过程如下。
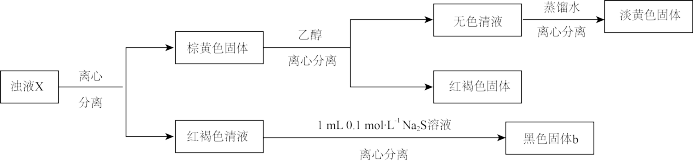
①通过对浊液X组成的检验,推测实验一的黑色沉淀a溶解过程中有氧化还原反应发生,实验证据是_______ 。
②经检测,黑色固体b的主要成分为FeS。甲同学认为,FeS是由红褐色清液中的 与加入的
与加入的 反应产生的。乙同学认为该解释不严谨,理由是
反应产生的。乙同学认为该解释不严谨,理由是_______ 。
(3)实验二制得了 ,但其中含少量
,但其中含少量 。
。
①生成 的离子方程式为
的离子方程式为_______ 。
②从化学反应速率角度推测实验二的棕黑色沉淀中不含S的原因:_______ 。
实验三
小组同学进行如下图所示的改进实验。经检验,黑色沉淀c为纯净的 。
。
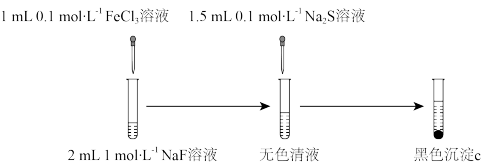
(4)实验三中,由无色清液生成 的离子方程式为
的离子方程式为_______ 。
【反思评价】
(5)对比三个实验,实验三能成功制备 的原因是
的原因是_______ 。
【查阅资料】
i.FeS、
ii.
iii.硫单质微溶于乙醇,难溶于水。
【设计并实施实验】
| 编号 | 实验一 | 实验二 |
| 操作 | 1.0mL 0.1 | 0.5mL 0.1 |
| 现象 | 迅速产生黑色沉淀a,振荡后黑色沉淀溶解,并产生臭鸡蛋气味的气体,最终得到棕黄色浊液X | 产生棕黑色沉淀 |
(2)进一步检验浊液X的组成,过程如下。

①通过对浊液X组成的检验,推测实验一的黑色沉淀a溶解过程中有氧化还原反应发生,实验证据是
②经检测,黑色固体b的主要成分为FeS。甲同学认为,FeS是由红褐色清液中的
(3)实验二制得了
①生成
②从化学反应速率角度推测实验二的棕黑色沉淀中不含S的原因:
实验三
小组同学进行如下图所示的改进实验。经检验,黑色沉淀c为纯净的

(4)实验三中,由无色清液生成
【反思评价】
(5)对比三个实验,实验三能成功制备
研究小组进行如图所示实验,试剂A为0.2 mol·L-1 CuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验 4,并记录实验现象:
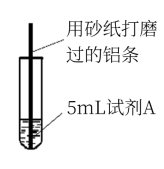
(1)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2 中加入NaCl固体的物质的量为___________ 。
(2)实验3的目的是___________ 。
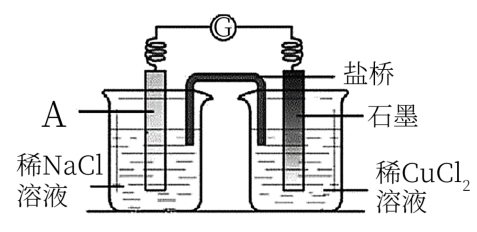
(3)经检验知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了如图所示实验证明该反应能够发生。能证明该反应发生的实验现象是___________ 。
(4)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
查阅资料知:CuCl难溶于水,能溶解在 Cl-浓度较大的溶液中,生成[CuCl2]-络离子, 用水稀释含[CuCl2]-的溶液时会重新析出CuCl沉淀。
①由上述实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与___________ 作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是___________ 。
(5)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与___________ 有关。

| 实验 序号 | 试剂A | 实验现象 |
| 1 | 0.2 mol·L-1 CuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
| 2 | 0.2 mol·L-1 CuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
| 3 | 2 mol·L-1 CuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
| 4 | 2 mol·L-1 CuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成 棕褐色,有红色固体和白色固体生成 |
(2)实验3的目的是
(3)经检验知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了如图所示实验证明该反应能够发生。能证明该反应发生的实验现象是

(4)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
| 实验序号 | 实验操作 | 实验现象 |
| i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
| ii | 加入饱和 AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
| iii | 向i 所得溶液中加入2 mol·L-1 CuCl2溶液 | 溶液由无色变为褐色 |
①由上述实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是
(5)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与
某实验小组探究AgNO3溶液与Na2SO3溶液的反应。
资料:Ag2SO3,白色固体,难溶于水;Ag2SO4,白色固体,微溶于水;AgOH,白色固体,常温下不稳定,易分解产生棕褐色固体。
(1)测得0.1mol/L Na2SO3溶液pH=10,用离子方程式解释原因:_______ 。
(2)实验小组对白色沉淀的成分提出猜想:
①可能含Ag2SO3。
②可能含Ag2SO4,理由是________ 。
③可能含AgOH。
实验产生的白色沉淀放置一段时间后未发生明显变化,排除猜想③。
(3)检验白色沉淀的成分
(资料:Ag++2S2O32− Ag(S2O3)23−,Ag(S2O3)23−在溶液中稳定存在。)
Ag(S2O3)23−,Ag(S2O3)23−在溶液中稳定存在。)

测得沉淀C质量小于沉淀B,试剂1和试剂2分别是_____ 、______ ,说明白色沉淀是Ag2SO3和Ag2SO4的混合物。
(4)探究白色沉淀消失的原因。实验小组设计对照实验:
① 补充实验Ⅲ的实验操作及现象:_______ ,证明SO32−使白色沉淀溶解。
② 查阅资料:Ag2SO3能溶于过量Na2SO3溶液中形成Ag(SO3)23−。白色沉淀中含有Ag2SO4,但还能全部溶解于Na2SO3溶液的原因是______ 。
(5)探究AgNO3溶液与Na2SO3溶液能否发生氧化还原反应。
步骤ii中Ag2SO3发生反应的离子方程式是_________ 。
(6)综合实验I和Ⅳ,说明AgNO3溶液与Na2SO3溶液的反应类型与_______ 有关。
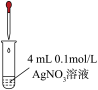
| 实验I | 操作 | 现象 |
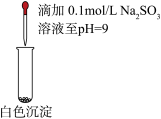
 | 滴加5滴0.1mol/L Na2SO3溶液,振荡 | 产生白色沉淀,测得混合溶液pH=5 |
| 继续滴加0.1mol/L Na2SO3溶液,振荡 | 白色沉淀增多,继续滴加,白色沉淀消失,测得混合溶液pH=9 |
(1)测得0.1mol/L Na2SO3溶液pH=10,用离子方程式解释原因:
(2)实验小组对白色沉淀的成分提出猜想:
①可能含Ag2SO3。
②可能含Ag2SO4,理由是
③可能含AgOH。
实验产生的白色沉淀放置一段时间后未发生明显变化,排除猜想③。
(3)检验白色沉淀的成分
(资料:Ag++2S2O32−

测得沉淀C质量小于沉淀B,试剂1和试剂2分别是
(4)探究白色沉淀消失的原因。实验小组设计对照实验:
| 实验Ⅱ | 实验Ⅲ | |
| 实验操作 |
|
|
| 现象 | 沉淀溶解 |
② 查阅资料:Ag2SO3能溶于过量Na2SO3溶液中形成Ag(SO3)23−。白色沉淀中含有Ag2SO4,但还能全部溶解于Na2SO3溶液的原因是
(5)探究AgNO3溶液与Na2SO3溶液能否发生氧化还原反应。
实验Ⅳ | 操作 | 现象 |
| 步骤i:滴加一定体积0.1 mol/L Na2SO3溶液 | 产生白色沉淀 |
| 步骤ii:再加入NaOH溶液调pH=14,振荡 | 白色沉淀变黑,经检验为Ag |
(6)综合实验I和Ⅳ,说明AgNO3溶液与Na2SO3溶液的反应类型与
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网