单选题 适中0.65 引用3 组卷310
为探究第三周期元素得失电子能力的强弱,进行了如表实验。操作、现象、结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 等物质的量的钠、镁与足量稀盐酸反应 | 同温同压下,收集到气体的体积V(Mg)=2V(Na) | 镁失电子数比钠多,镁比钠活泼 |
| B | 向AlCl3溶液中逐滴加入稀氨水至过量 | 产生白色沉淀逐渐增多,后慢慢溶解 | 碱性:NH3·H2O>Al(OH)3 |
| C | 将浓盐酸加入到NaHSO3溶液中 | 产生能使品红褪色的气体 | 氧化性:Cl2>S |
| D | 将Cl2通入Na2S溶液中 | 产生淡黄色沉淀 | 得电子能力:Cl>S |
| A.A | B.B | C.C | D.D |
21-22高一下·山东青岛·期中
类题推荐
下表实验中操作、现象、结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将表面积相同且用砂纸打磨后的镁条、铝条分别放入沸水中 | 镁条剧烈反应产生大量气体,溶液迅速变浑浊;铝条与沸水无明显现象 | 镁的失电子能力比铝强 |
| B | 向 | 产生白色沉淀逐渐增多,后慢慢溶解 | 碱性: |
| C | 将铜片和铁片分别放入浓硝酸中 | 铜片产生大量气体,铁片无明显现象 | 铜比铁活泼 |
| D | 将 | 产生淡黄色沉淀 | 得电子能力: |
| A.A | B.B | C.C | D.D |
下列实验操作、现象和所得结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将Cu(NO3)2加热产生的气体集满试管并倒扣到水槽中 | 红棕色气体消失,水充满试管 | 红棕色气体中n(NO2)与n(O2)之比为1:4 |
| B | 将Cl2和H2S气体在集气瓶中混合 | 瓶壁上出现黄色固体 | Cl2的氧化性比S强 |
| C | 向含有少量铜粉的Cu(NO3)2溶液中滴入稀硫酸 | 铜粉逐渐溶解 | 稀硫酸能与铜单质反应 |
| D | 向久置的Na2SO3溶液中加入足量BaCl2溶液;再加入足量稀盐酸 | 先出现白色沉淀,后部分沉淀溶解 | 久置的Na2SO3部分被氧化 |
| A.A | B.B | C.C | D.D |
同周期的元素性质递变规律
(1)钠、镁与水的反应
(2)Al(OH)3的制备与性质
实验探究:
①向AlCl3溶液中加入足量氨水,现象为__________ ,反应的离子方程式为__________ ;
②将①实验得到的沉淀分装两支试管中,一支试管中加入盐酸,现象为__________ ,离子方程式为_________ ;另一支试管中加入NaOH溶液,现象为________ ,离子方程式为______________ 。
③向MgCl2溶液加入过量NaOH溶液,现象_________ ,离子方程式为_____________ 。
两性氢氧化物:既能与酸反应又能与强碱反应,且均生成盐和水的氢氧化物。如 Al(OH)3。
(3)第三周期递变规律
①第三周期的Na、Mg、Al的金属性逐渐__________ ,NaOH、Mg(OH)2、Al(OH)3的碱性逐渐__________ ,NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物。
②第三周期的Si、P、S、Cl的非金属性逐渐__________ ,H3SiO3、H3PO4、H2SO4、HClO4的酸性逐渐__________ 。HClO4是最强的含氧酸,H2SiO3为难溶的弱酸,H3PO4为中强酸,H2SO4为强酸。
③同一周期从左到右,原子半径逐渐__________ ,失电子能力逐渐__________ ,得电子能力逐渐__________ ,金属性逐渐__________ ,非金属性逐渐__________ 。
(1)钠、镁与水的反应
| 钠 | 镁 | |
| 实验操作 | 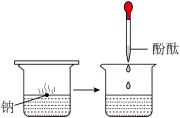 实验① 实验① | 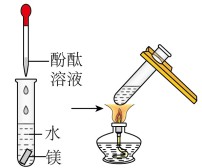 实验② 实验② |
| 实验现象 | 钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红 | 加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色 |
| 反应原理 | ||
| 结论 | 钠、镁均能与水反应,钠比镁活泼,金属性: | |
实验探究:
①向AlCl3溶液中加入足量氨水,现象为
②将①实验得到的沉淀分装两支试管中,一支试管中加入盐酸,现象为
③向MgCl2溶液加入过量NaOH溶液,现象
两性氢氧化物:既能与酸反应又能与强碱反应,且均生成盐和水的氢氧化物。如 Al(OH)3。
(3)第三周期递变规律
①第三周期的Na、Mg、Al的金属性逐渐
②第三周期的Si、P、S、Cl的非金属性逐渐
③同一周期从左到右,原子半径逐渐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


