解答题-工业流程题 适中0.65 引用1 组卷246
高锰酸钾(KMnO4)在工业中广泛用作为氧化剂,工业上常用软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。制备高锰酸钾分两个阶段进行。
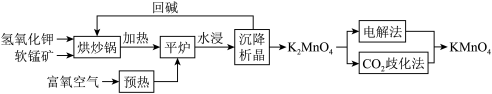
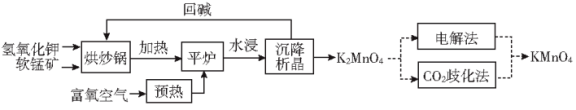
阶段一:制备锰酸钾(K2MnO4),工艺流程流程如下:
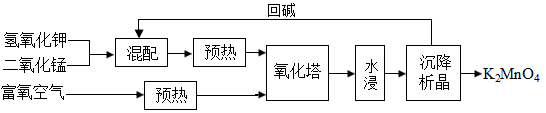
(1)原料加入氧化塔前必须粉碎、预热,目的是_______ 。
(2)在氧化塔,反应分两步进行:
第一步反应生成K3MnO4,反应方程式为_______ 。
第二步反应方程式为4K3MnO4+O2+2H2O 4K2MnO4+4KOH
4K2MnO4+4KOH
阶段二:制备高锰酸钾(KMnO4)
工业中,用锰酸钾制备高锰酸钾有两种方法。
(3)方法一:电解法
工业上采用惰性电极电解锰酸钾溶液,电解反应的化学方程式为2K2MnO4+2H2O 2KMnO4+H2↑+2KOH,阴极上电极反应为
2KMnO4+H2↑+2KOH,阴极上电极反应为_______ 。
(4)方法二:歧化法
相关资料:锰酸钾在强碱性溶液中稳定,在酸性、中性和弱碱性环境下, 会发生歧化反应。20℃时下列各物质溶解度如下表。
会发生歧化反应。20℃时下列各物质溶解度如下表。
工业中常用CO2歧化法制备高锰酸钾,工艺流程如下:
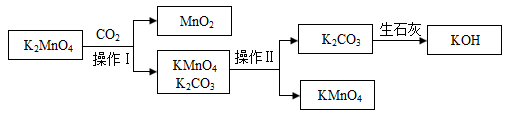
①在该制备过程可循环使用的物质有_______ 、_______ (写化学式)
②操作Ⅱ是将混合液_______ 、_______ 、过滤。
③在酸性条件下,锰酸钾发生歧化反应,工业中用歧化法制高锰酸钾时,用CO2进行酸化,而不用硫酸或盐酸酸化的原因是_______ 。
(5)高锰酸钾是实验室重要试剂,可用于硫酸亚铁样品纯度的测定。取1.000克硫酸亚铁样品溶于蒸馏水,用容量瓶配成100毫升溶液,取出其中20.00mL溶液注入锥形瓶中,加入适量的稀硫酸酸化,用0.0100mol/L的KMnO4标准液进行滴定,当溶液变为微红色且半分钟不褪色时,消耗KMnO4标准液20.00mL,则样品中硫酸亚铁的纯度为_______ 。
阶段一:制备锰酸钾(K2MnO4),工艺流程流程如下:

(1)原料加入氧化塔前必须粉碎、预热,目的是
(2)在氧化塔,反应分两步进行:
第一步反应生成K3MnO4,反应方程式为
第二步反应方程式为4K3MnO4+O2+2H2O
阶段二:制备高锰酸钾(KMnO4)
工业中,用锰酸钾制备高锰酸钾有两种方法。
(3)方法一:电解法
工业上采用惰性电极电解锰酸钾溶液,电解反应的化学方程式为2K2MnO4+2H2O
(4)方法二:歧化法
相关资料:锰酸钾在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,
| 物质 | KMnO4 | K2CO3 | K2SO4 |
| 溶解度 | 6.38 | 111 | 11.1 |
工业中常用CO2歧化法制备高锰酸钾,工艺流程如下:

①在该制备过程可循环使用的物质有
②操作Ⅱ是将混合液
③在酸性条件下,锰酸钾发生歧化反应,工业中用歧化法制高锰酸钾时,用CO2进行酸化,而不用硫酸或盐酸酸化的原因是
(5)高锰酸钾是实验室重要试剂,可用于硫酸亚铁样品纯度的测定。取1.000克硫酸亚铁样品溶于蒸馏水,用容量瓶配成100毫升溶液,取出其中20.00mL溶液注入锥形瓶中,加入适量的稀硫酸酸化,用0.0100mol/L的KMnO4标准液进行滴定,当溶液变为微红色且半分钟不褪色时,消耗KMnO4标准液20.00mL,则样品中硫酸亚铁的纯度为
2022·广东·模拟预测
类题推荐
二氧化锰和高锰酸钾是重要的化学用品
文献资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
Ⅰ.用软锰矿吸收含SO2的废气,制备高纯度的硫酸锰晶体
已知:①
②
③
(1)固体MnO2和SO2(g)反应生成MnSO4固体的热化学方程式为___________ 。
Ⅱ.工业上常用软锰矿(主要成分MnO2)为原料制备高锰酸钾。其方法为:将软锰矿(主要成分MnO2)充分粉碎后与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液(主要成分为K2MnO4)。再将K2MnO4溶液采用惰性电极隔膜法电解,制得KMnO4。
(2)软锰矿与KOH固体混合焙烧前充分粉碎的原因是___________ 。
(3)焙烧时发生反应的化学方程式为___________ 。
(4)固体研细后用稀KOH溶液浸取的原因是___________ 。
(5)用惰性电极隔膜法电解K2MnO4溶液的装置为如下:
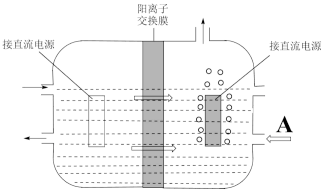
①a极的电极反应为___________ 。
②研究发现,用无膜法电解时,锰元素利用较低,其原因是___________ 。
Ⅲ.测定KMnO4产品的纯度
(6)测定KMnO4产品的纯度可用标准Na2SO3溶液滴定。
①取某KMnO4产品0.5000g溶于水,并加入___________ (填字母)进行酸化。
A.稀盐酸 B.稀硫酸 C.硝酸 D.次氯酸
②所得溶液用0.2000 mol/L标准Na2SO3溶液进行滴定,滴定至终点记录实验消耗Na2SO3溶液的体积。
重复步骤①②,三次平行实验数据如表:
(有关离子方程式为 )
)
计算该KMnO4 (式量为:158)产品的纯度为___________ (结果保留三位有效数字)。
文献资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
Ⅰ.用软锰矿吸收含SO2的废气,制备高纯度的硫酸锰晶体
已知:①
②
③
(1)固体MnO2和SO2(g)反应生成MnSO4固体的热化学方程式为
Ⅱ.工业上常用软锰矿(主要成分MnO2)为原料制备高锰酸钾。其方法为:将软锰矿(主要成分MnO2)充分粉碎后与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液(主要成分为K2MnO4)。再将K2MnO4溶液采用惰性电极隔膜法电解,制得KMnO4。
(2)软锰矿与KOH固体混合焙烧前充分粉碎的原因是
(3)焙烧时发生反应的化学方程式为
(4)固体研细后用稀KOH溶液浸取的原因是
(5)用惰性电极隔膜法电解K2MnO4溶液的装置为如下:

①a极的电极反应为
②研究发现,用无膜法电解时,锰元素利用较低,其原因是
Ⅲ.测定KMnO4产品的纯度
(6)测定KMnO4产品的纯度可用标准Na2SO3溶液滴定。
①取某KMnO4产品0.5000g溶于水,并加入
A.稀盐酸 B.稀硫酸 C.硝酸 D.次氯酸
②所得溶液用0.2000 mol/L标准Na2SO3溶液进行滴定,滴定至终点记录实验消耗Na2SO3溶液的体积。
重复步骤①②,三次平行实验数据如表:
| 实验次数 | 1 | 2 | 3 |
| 消耗 | 19.30 | 20.98 | 21.02 |
(有关离子方程式为
计算该KMnO4 (式量为:158)产品的纯度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网