解答题-原理综合题 较难0.4 引用1 组卷226
高铁酸盐( )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。已知:
)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。已知:
ⅰ) 具有强氧化性,易被
具有强氧化性,易被 、
、 及空气中的还原性气体还原。
及空气中的还原性气体还原。
ⅱ) 在
在 或
或 催化作用下分解。
催化作用下分解。
ⅲ) 分解速率方程为
分解速率方程为 。
。
Ⅰ.Johnson提出由过-硫酸氢钾复合盐( )溶液,在冰盐水浴条件下,将
)溶液,在冰盐水浴条件下,将 氧化为
氧化为 ,装置如图所示:
,装置如图所示:
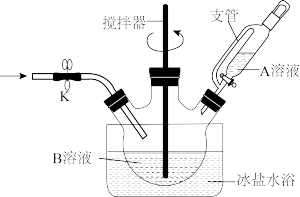
(1)A溶液为_______ (填“a”或“b”)。
a.过-硫酸氢钾复合盐溶液 b. 溶液
溶液
(2)过-硫酸结构简式为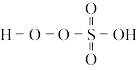 ,则
,则 中的S为+
中的S为+_______ 价。
(3)反应中需全程维持冰盐水浴,原因是_______ 。(任答一条即可)
Ⅱ.Poggendorf首次发现使用铁电极在浓NaOH溶液中,利用“电解法”合成高铁酸盐,原理为: 。
。
(4)电解过程中,电解槽中出现红色浑浊,用离子方程式和文字解释可能原因:_______ (任答一条即可)。
(5)采用如图“隔膜电解法”,可以解决电解过程中出现红色沉淀的问题。
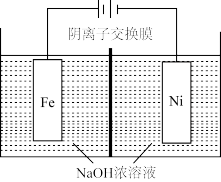
①阳极区加入某种电解质,能避免 被还原,宜加入
被还原,宜加入_______ (填序号,单选)。
a.NaCl b. c.
c. d.
d.
②当阴极区产生6.72L(标况下) 时,阳极区溶液的质量变化量为
时,阳极区溶液的质量变化量为_______ g。(不考虑 的迁移)
的迁移)
Ⅲ. 与水分子结合会发生质子化,并存在平衡
与水分子结合会发生质子化,并存在平衡 。常温下,0.1
。常温下,0.1 的高铁酸盐溶液中,含铁粒子的分布系数随pH的变化如图所示。
的高铁酸盐溶液中,含铁粒子的分布系数随pH的变化如图所示。
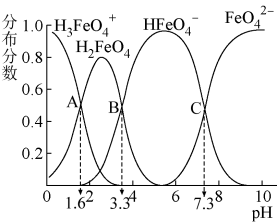
(6)溶液中水的电离程度:A点_______ C点(填“>”“<”或“=”)。
(7)当溶液pH=3时,
_______ :_______ 。
ⅰ)
ⅱ)
ⅲ)
Ⅰ.Johnson提出由过-硫酸氢钾复合盐(

(1)A溶液为
a.过-硫酸氢钾复合盐溶液 b.
(2)过-硫酸结构简式为
 ,则
,则(3)反应中需全程维持冰盐水浴,原因是
Ⅱ.Poggendorf首次发现使用铁电极在浓NaOH溶液中,利用“电解法”合成高铁酸盐,原理为:
(4)电解过程中,电解槽中出现红色浑浊,用离子方程式和文字解释可能原因:
(5)采用如图“隔膜电解法”,可以解决电解过程中出现红色沉淀的问题。

①阳极区加入某种电解质,能避免
a.NaCl b.
②当阴极区产生6.72L(标况下)
Ⅲ.

(6)溶液中水的电离程度:A点
(7)当溶液pH=3时,
21-22高三下·重庆沙坪坝·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
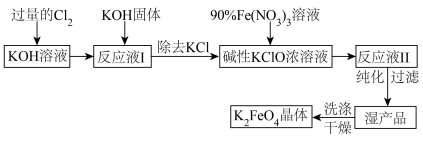
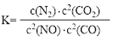 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式: 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。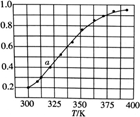
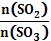 =1加入SO2和SO3,平衡将
=1加入SO2和SO3,平衡将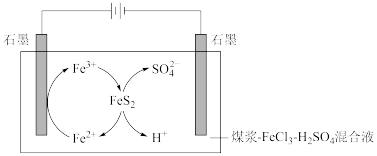
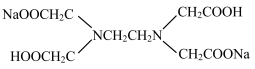 )溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是
)溶液中,每个H2Y2-电离出2个H+生成酸根Y4-,然后与Fe3+配位。已知该配位反应受溶液pH的影响,若溶液pH太低或太高,分别存在的问题是

