解答题-工业流程题 适中0.65 引用4 组卷496
Mn及其化合物在工业生产中具有重要的用途。
I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
(1)Mn在_______ (填“阳极”或“阴极”)生成。
(2)阳极泥中含有MnO2,写出产生MnO2的电极反应式:_______ 。
II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。
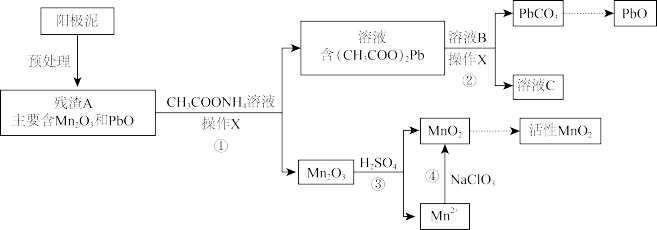
已知:(CH3COO)2Pb在水中难解离。
(3)操作X为_______ 。
(4)①中反应的离子方程式为_______ 。
(5)滤液C能循环使用,②中溶液B的溶质为_______ 。
(6)a.为了将③中Mn2O3完全转化为MnO2,理论上④中加入的NaClO3与Mn2O3的物质的量之比为_______ (已知NaClO3的还原产物为NaCl)。
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是_______ 。
(7)活性MnO2纯度的测定
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+ +4H+=2CO2↑+Mn2++2H2O)
+4H+=2CO2↑+Mn2++2H2O)
ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的 消耗KMnO4标准溶液V2mL。(5
消耗KMnO4标准溶液V2mL。(5 +2
+2 +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)
样品中MnO2的质量分数=_______ [M(MnO2)=87g·mol-1]。
I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
(1)Mn在
(2)阳极泥中含有MnO2,写出产生MnO2的电极反应式:
II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。

已知:(CH3COO)2Pb在水中难解离。
(3)操作X为
(4)①中反应的离子方程式为
(5)滤液C能循环使用,②中溶液B的溶质为
(6)a.为了将③中Mn2O3完全转化为MnO2,理论上④中加入的NaClO3与Mn2O3的物质的量之比为
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是
(7)活性MnO2纯度的测定
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+
ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的
样品中MnO2的质量分数=
2022·北京东城·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



 CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:


