解答题-工业流程题 较难0.4 引用2 组卷322
下图是一种处理废锌锰干电池的流程,电池内除铜帽、锌皮(含少量铁)、石墨棒外,还含有MnOOH、ZnCl2、NH4Cl、C及有机物等糊状填充物。
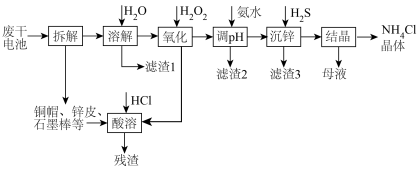
回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有_______ ;(写一条即可)
(2)将“滤渣1”灼烧有 生成,产生
生成,产生 的化学方程式为
的化学方程式为_______ ;
(3)“氧化”过程中,还原产物是_______ ;
(4)“滤渣2”的主要成分是_______ ;
(5)“调pH”时,应控制溶液pH的范围是_______ ;(已知:“溶解”后的溶液中c(Zn2+)=0.10mol/L,忽略滴加 、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)
、氨水后溶液的体积变化;Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3)
(6)写出“沉锌”的离子方程式________ ;
(7)测定NH4Cl晶体中的氮元素含量:准确称取样品0.100g放至锥形瓶中,加适量的水完全溶解,再加5mL中性甲醛溶液(足量),摇匀,静置,用0.100mol/L的NaOH标准溶液平行滴定三次,消耗标准溶液的平均体积为18.50mL,则样品中氮元素的质量分数为_______ 。
[已知:4 +6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]
+6HCHO=(CH2)6N4H++3H++6H2O;(CH2)6N4H++3H++4OH-=(CH2)6N4+4H2O]

回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有
(2)将“滤渣1”灼烧有
(3)“氧化”过程中,还原产物是
(4)“滤渣2”的主要成分是
(5)“调pH”时,应控制溶液pH的范围是
(6)写出“沉锌”的离子方程式
(7)测定NH4Cl晶体中的氮元素含量:准确称取样品0.100g放至锥形瓶中,加适量的水完全溶解,再加5mL中性甲醛溶液(足量),摇匀,静置,用0.100mol/L的NaOH标准溶液平行滴定三次,消耗标准溶液的平均体积为18.50mL,则样品中氮元素的质量分数为
[已知:4
2022·福建龙岩·三模
类题推荐
下图是一种处理废锌锰干电池的流程,电池内除铜帽、锌皮(含少量铁)、石墨棒外,还含有MnOOH、ZnCl2、NH4Cl、C及有机物等糊状填充物。

已知:Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3,Ka1(H2S)=10-7,Ka2(H2S)=10-13,Ksp(ZnS)=2×10-24。
请回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有___________ (写一条即可)。
(2)对于以上流程,下列说法不正确的是:___________。
(3)常温下,“调pH”时,应控制溶液pH的范围是[a,b),具体的范围是___________ 。(已知:“溶解”后的溶液中c(Zn2+)=0.10mol/L,一般某离子浓度≤10-5mol/L时认为沉淀完全。忽略滴加H2O2、氨水后溶液的体积变化。)
(4)写出“沉锌”的离子方程式___________ ,此反应的平衡常数为___________ 。

已知:Ksp[Zn(OH)2]=10-17,Ksp[Fe(OH)2]=10-17,Ksp[Fe(OH)3]=10-38.3,Ka1(H2S)=10-7,Ka2(H2S)=10-13,Ksp(ZnS)=2×10-24。
请回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有
(2)对于以上流程,下列说法不正确的是:___________。
| A.由NH4Cl溶液得到NH4Cl晶体的方式为蒸发结晶 |
| B.“调pH”生成“滤渣2”的离子方程式为:2NH3·H2O+Fe2+=Fe(OH)2+ |
| C.“酸溶”时的反应速率比同浓度盐酸与同规格纯锌片反应的速率快 |
| D.将“滤渣1”在空气中灼烧可能有MnO2生成 |
(3)常温下,“调pH”时,应控制溶液pH的范围是[a,b),具体的范围是
(4)写出“沉锌”的离子方程式
MnO2常用作氧化剂和催化剂,以某含锰矿石[主要成分为MnCO3,含有少量Cu2(OH)2CO3、Fe3O4、CaO、MgO和NiO等]为原料制备MnO2,同时回收Ni2+用于制备可充电镍氢电池。主要流程如图:

已知:Ⅰ.相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
Ⅱ.Ksp(CaF2)=4.0×10-11,Ksp(MgF2)=1.0×10-10
回答下列问题:
(1)为提高酸浸的速率,可以采取的措施有_______ (写出两种方法)。
(2)加入H2O2的目的是_______ 。
(3)“调pH除杂”后滤渣1中的成分除含有Cu(OH)2、CaSO4外还有_______ ,该步骤中应调节的pH范围为_______ 。
(4)“沉淀除杂”时加入适量NaF溶液除Mg2+、Ca2+。若溶液中Mg2+和Ca2+完全沉淀(沉淀完全时,离子浓度小于1.0×10-5mol/L),则滤液中F-的最低浓度为_______ 。
(5)有机相提取出的Ni2+再生时可用于制备可充电镍氢(储氢)电池,该电池的总反应为NiOOH+MH Ni(OH)2+M,电解质溶液为KOH溶液,则放电时正极反应式为
Ni(OH)2+M,电解质溶液为KOH溶液,则放电时正极反应式为_______ 。
(6)“沉锰”过程中生成MnCO3,写出该反应的离子方程式_______ 。
(7)MnO2质量分数的测定:取ag产品于烧杯中,加入足量的甲苯和硫酸溶液,生成苯甲醛、硫酸锰和水,萃取分液得到无机相,于100mL容量瓶中定容。每次移取10.00mL所配溶液,用bmol/L标准的Na2S2O8溶液进行滴定,发生反应Mn2++S2O +H2O→MnO
+H2O→MnO +SO
+SO +H+(未配平),平行滴定三次,平均消耗Na2S2O8标准溶液VmL。则产品中MnO2的质量分数为
+H+(未配平),平行滴定三次,平均消耗Na2S2O8标准溶液VmL。则产品中MnO2的质量分数为_______ (用含a、b、V的式子表示)。

已知:Ⅰ.相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Mg2+ | Cu2+ | Ni2+ | Mn2+ |
| 开始沉淀pH | 2.7 | 6.3 | 9.3 | 4.8 | 6.4 | 8.1 |
| 完全沉淀pH | 3.7 | 8.3 | 10.8 | 6.3 | 9.2 | 10.1 |
回答下列问题:
(1)为提高酸浸的速率,可以采取的措施有
(2)加入H2O2的目的是
(3)“调pH除杂”后滤渣1中的成分除含有Cu(OH)2、CaSO4外还有
(4)“沉淀除杂”时加入适量NaF溶液除Mg2+、Ca2+。若溶液中Mg2+和Ca2+完全沉淀(沉淀完全时,离子浓度小于1.0×10-5mol/L),则滤液中F-的最低浓度为
(5)有机相提取出的Ni2+再生时可用于制备可充电镍氢(储氢)电池,该电池的总反应为NiOOH+MH
(6)“沉锰”过程中生成MnCO3,写出该反应的离子方程式
(7)MnO2质量分数的测定:取ag产品于烧杯中,加入足量的甲苯和硫酸溶液,生成苯甲醛、硫酸锰和水,萃取分液得到无机相,于100mL容量瓶中定容。每次移取10.00mL所配溶液,用bmol/L标准的Na2S2O8溶液进行滴定,发生反应Mn2++S2O
碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(Cu2S,含有SiO2和少量Fe2O3等杂质)为原料制备碱式碳酸铜的流程如图所示:

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有___ (任写一种)。
(2)滤渣I经CS2提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是___ (填化学式)。回收淡黄色副产品过程中温度控制在50~60℃之间,不宜过高或过低的原因是___ 。
(3)常温下“除铁”时加入的试剂A可用CuO,调节pH的范围为___ ,若加A后将溶液的pH调为5,则溶液中Fe3+的浓度为___ mol/L。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:___ 。
(5)“赶氨”时,最适宜的操作方法是___ 。
(6)测定副产品MnSO4·H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为___ (保留到小数点后两位)。

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀的pH | 9.0 | 3.7 | 6.7 | 9.8 |
③Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣I经CS2提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是
(3)常温下“除铁”时加入的试剂A可用CuO,调节pH的范围为
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:
(5)“赶氨”时,最适宜的操作方法是
(6)测定副产品MnSO4·H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


