解答题-原理综合题 较难0.4 引用1 组卷180
碳中和的含义是减少含碳温室气体的排放,采用合适的技术固碳,最终达到平衡。
(1)下列措施对实现“碳中和”不具有直接贡献的一项是_______。
(2)二氧化碳加氢制备甲醇可有效缓解温室效应问题。
已知:(I)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+42.3kJ/mol
(II)CH3OH(g)=CO(g)+2H2(g) ΔH2
(III)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=-49.4kJ/mol
①ΔH2=_______ 。
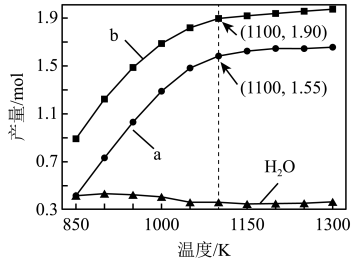
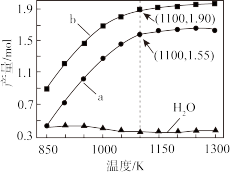
②在260°C、5MPa恒容条件下发生反应(III),原料气体积组成为V(CO2):V(H2):V(N2)=1:3:l,平衡时CO2的转化率为50%,则H2的压强为_______ MPa,反应(III)的平衡常数:Kp=_______ (MPa)-2(计算结果精确至小数点后两位,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)Ni-CeO2催化CO2加H2形成CH4的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图2所示。
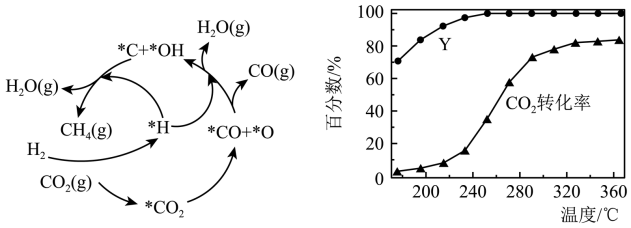
①下列对CO2甲烷化反应体系的说法不合理的有_______ 。
A.存在副反应CO2+H2 CO+H2O
CO+H2O
B.存在反应CO2+4H2 CH4+2H2O
CH4+2H2O
C.含碳副产物的产率均高于CH4
D.温度高于360°C后,升高温度,甲烷产率将继续保持不变
②CO2甲烷化的过程中,保持CO2与H2的体积比为1:5,反应气的总流量控制在36mL·min-1,260°C时测得CO2转化率为40%,则H2反应速率为_______ mL·min-1。
(1)下列措施对实现“碳中和”不具有直接贡献的一项是_______。
| A.采取节能低碳生活方式 |
| B.推行生活垃圾分类 |
| C.植树造林增加绿色植被 |
| D.燃煤锅炉改烧天然气 |
已知:(I)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+42.3kJ/mol
(II)CH3OH(g)=CO(g)+2H2(g) ΔH2
(III)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=-49.4kJ/mol
①ΔH2=
②在260°C、5MPa恒容条件下发生反应(III),原料气体积组成为V(CO2):V(H2):V(N2)=1:3:l,平衡时CO2的转化率为50%,则H2的压强为
(3)Ni-CeO2催化CO2加H2形成CH4的反应历程如图1所示(吸附在催化剂表面的物种用*标注),含碳产物中CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图2所示。

①下列对CO2甲烷化反应体系的说法不合理的有
A.存在副反应CO2+H2
B.存在反应CO2+4H2
C.含碳副产物的产率均高于CH4
D.温度高于360°C后,升高温度,甲烷产率将继续保持不变
②CO2甲烷化的过程中,保持CO2与H2的体积比为1:5,反应气的总流量控制在36mL·min-1,260°C时测得CO2转化率为40%,则H2反应速率为
21-22高二下·四川成都·期中
类题推荐
CO2综合利用是降低碳排放的有效手段,有利于实现碳中和目标。下列是CO2综合利用的化学方法,回答下列问题:
(1)用氨水吸收CO2制化肥(NH4HCO3)。
①已知:NH3·H2O(aq)= (aq)+OH-(aq) ΔH1=akJ·mol-1
(aq)+OH-(aq) ΔH1=akJ·mol-1
CO2(g)+H2O(l)=H2CO3(aq) ΔH2=bkJ·mol-1
H2CO3(aq)+OH-(aq)= (aq)+H2O(l) ΔH3=ckJ·mol-1
(aq)+H2O(l) ΔH3=ckJ·mol-1
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为_______ 。
②已知常温下相关数据如表:
则反应 +
+ +H2O⇌NH3·H2O+H2CO3的平衡常数K=
+H2O⇌NH3·H2O+H2CO3的平衡常数K=_______ 。
③分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图1所示,若烟气中CO2的含量(体积分数)为15%,烟气通入氨水的流量为0.065m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,则脱除的CO2的物质的量最多为_______ (精确到0.01)。

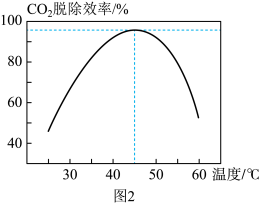
④CO2脱除效率与温度的关系如图2所示,高于45℃时,CO2脱除效率降低的原因可能是_______ (答出一条即可)。
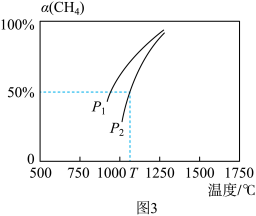
(2)用CO2和天然气可以制备CO和H2:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol·L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率[α(CH4)]与温度及压强的关系如图3所示,则压强p1_______ p2(填“>”或“<”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_______ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2和H2在一定条件下合成甲醇。在2L恒容密闭容器中充入总物质的量为6mol的CO2和H2,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),改变氢碳比[n(H2)/n(CO2)],在不同温度下反应达到平衡状态,测得的实验数据如下表。
①氢碳比为1.5,温度为500K,判断该可逆反应达到平衡状态的依据是_______ (填标号)。
A.在相同时间段内,CH3OH的生成速率和CO2的消耗速率相等
B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变
D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
②在700K、氢碳比为3.0条件下,若5min时反应达到平衡状态,则0~5min内用H2表示的平均反应速率为_______ 。
(1)用氨水吸收CO2制化肥(NH4HCO3)。
①已知:NH3·H2O(aq)=
CO2(g)+H2O(l)=H2CO3(aq) ΔH2=bkJ·mol-1
H2CO3(aq)+OH-(aq)=
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为
②已知常温下相关数据如表:
| Kb(NH3·H2O) | 2.0×10-5 |
| Ka1(H2CO3) | 5.0×10-7 |
| Ka2(H2CO3) | 4.0×10-11 |
则反应
③分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图1所示,若烟气中CO2的含量(体积分数)为15%,烟气通入氨水的流量为0.065m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,则脱除的CO2的物质的量最多为

④CO2脱除效率与温度的关系如图2所示,高于45℃时,CO2脱除效率降低的原因可能是

(2)用CO2和天然气可以制备CO和H2:CO2(g)+CH4(g)⇌2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol·L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率[α(CH4)]与温度及压强的关系如图3所示,则压强p1

(3)CO2和H2在一定条件下合成甲醇。在2L恒容密闭容器中充入总物质的量为6mol的CO2和H2,发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),改变氢碳比[n(H2)/n(CO2)],在不同温度下反应达到平衡状态,测得的实验数据如下表。
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 40 | 22 |
①氢碳比为1.5,温度为500K,判断该可逆反应达到平衡状态的依据是
A.在相同时间段内,CH3OH的生成速率和CO2的消耗速率相等
B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变
D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
②在700K、氢碳比为3.0条件下,若5min时反应达到平衡状态,则0~5min内用H2表示的平均反应速率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网