解答题-原理综合题 适中0.65 引用1 组卷308
甲醇是重要的化工基础原料和清洁液体燃料,在CO2加氢合成CH3OH的体系中,同时发生下列竞争反应:
(ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.3 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.3 kJ/mol
(ⅱ)CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1 kJ/mol
CO(g)+H2O(g) △H2=+41.1 kJ/mol
由CO也能直接加氢合成甲醇:(iii) 2H2(g)+CO(g) CH3OH(g) △H
CH3OH(g) △H
(1)△H =_______ kJ/mol。
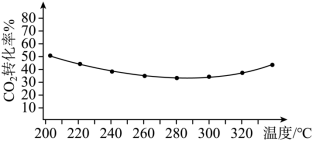
(2)反应(ⅱ) CO2(g)+H2(g) CO(g)+H2O(g)的正、逆反应平衡常数随温度变化曲线如图所示。
CO(g)+H2O(g)的正、逆反应平衡常数随温度变化曲线如图所示。
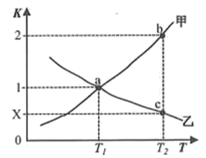
下列分析正确的是_______ 。
A.曲线甲为K(逆),曲线乙为K(正)
B.a点时,一定有v正=v逆
C.c点时,x=0.5
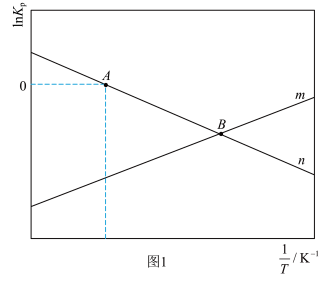
(3)催化剂M、N对CO2(g)+3H2(g) CH3OH(g)+H2O(g)反应进程的能量影响如下图(a)所示,两种催化剂对应的1nk~
CH3OH(g)+H2O(g)反应进程的能量影响如下图(a)所示,两种催化剂对应的1nk~ 关系如下图(b)所示(已知;lnk=-
关系如下图(b)所示(已知;lnk=- +C,其中Ea为活化能,k为速率常数,R和C为常数)。
+C,其中Ea为活化能,k为速率常数,R和C为常数)。
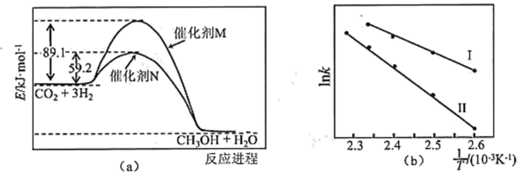
①使用催化剂M时,逆反应的活化能为_______ kJ/mol。
②催化剂N对应曲线是图(b)中的_______ (填“Ⅰ”或“Ⅱ”)
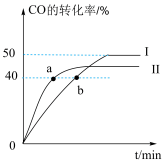
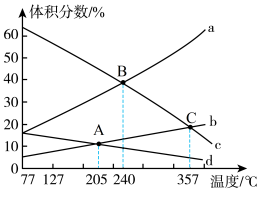
(4)为进一步研究CO2与H2反应制CH3OH的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内,测得甲醇生成速率与温度的关系如图所示。
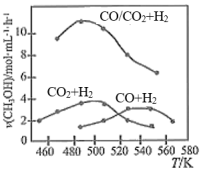
①三个容器中,甲醇的生成速率达峰值后均随温度升高而下降的原因是_______ 。
②结合研究目的,参照图中三条曲线,你可得出的结论是_______ (写一条)。
(5)恒温下,在压强恒定为P的装置中,按n(CO2):n(H2)=1:3加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若CO2转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g)的平衡常数计算式:Kp=
CH3OH(g)+H2O(g)的平衡常数计算式:Kp=_______ (不必化简)。(已知: 的选择性x=
的选择性x= ×100%;Kp为用分压代替浓度的平衡常数。)
×100%;Kp为用分压代替浓度的平衡常数。)
(ⅰ)CO2(g)+3H2(g)
(ⅱ)CO2(g)+H2(g)
由CO也能直接加氢合成甲醇:(iii) 2H2(g)+CO(g)
(1)△H =
(2)反应(ⅱ) CO2(g)+H2(g)

下列分析正确的是
A.曲线甲为K(逆),曲线乙为K(正)
B.a点时,一定有v正=v逆
C.c点时,x=0.5
(3)催化剂M、N对CO2(g)+3H2(g)

①使用催化剂M时,逆反应的活化能为
②催化剂N对应曲线是图(b)中的
(4)为进一步研究CO2与H2反应制CH3OH的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内,测得甲醇生成速率与温度的关系如图所示。

①三个容器中,甲醇的生成速率达峰值后均随温度升高而下降的原因是
②结合研究目的,参照图中三条曲线,你可得出的结论是
(5)恒温下,在压强恒定为P的装置中,按n(CO2):n(H2)=1:3加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若CO2转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)CO2(g)+3H2(g)
2022·福建三明·三模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网