解答题-实验探究题 较难0.4 引用2 组卷265
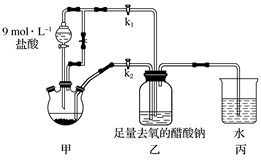
乙酸亚铬水合物是红棕色晶体,其化学式为 ,不溶于冷水、乙醇、乙醚,易溶于盐酸,非常不稳定,能够迅速被空气中的氧气氧化为三价铬。实验室常用锌粒、
,不溶于冷水、乙醇、乙醚,易溶于盐酸,非常不稳定,能够迅速被空气中的氧气氧化为三价铬。实验室常用锌粒、 和醋酸钠制备乙酸亚铬水合物,装置甲中依次观察到溶液中发生暗绿→绿→蓝绿→亮蓝一系列颜色变化,实验装置如图所示。请回答下列问题:
和醋酸钠制备乙酸亚铬水合物,装置甲中依次观察到溶液中发生暗绿→绿→蓝绿→亮蓝一系列颜色变化,实验装置如图所示。请回答下列问题:
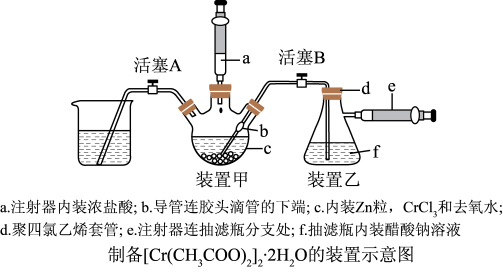
(1)装置甲中仪器c的名称为_______ 。
(2)装置乙中发生反应的离子方程式为_______ 。
(3)检查气密性良好后装入药品,活塞A和活塞B均为闭合状态,滴入浓盐酸时,应打开活塞_______ ,当_______ (描述实验现象)时,应关闭该活塞,打开另一个活塞。
(4)装置甲中的液体能够快速流入装置乙中的原因是_______ 。
(5)反应结束后,用布氏漏斗将所得混合物减压抽滤,先用去氧水洗3次,然后用少量乙醇、乙醚各洗涤3次,将产品铺于表面皿上,室温下干燥。用乙醇、乙醚洗涤的原因_______ 。
(6)某实验室探究减少盐酸的用量对实验进行改进,实验结果如表。试分析实验①产率较低的原因_______ 。实验⑤的优点有节约药品、_______ 。
稀释浓盐酸后的实验结果对比

(1)装置甲中仪器c的名称为
(2)装置乙中发生反应的离子方程式为
(3)检查气密性良好后装入药品,活塞A和活塞B均为闭合状态,滴入浓盐酸时,应打开活塞
(4)装置甲中的液体能够快速流入装置乙中的原因是
(5)反应结束后,用布氏漏斗将所得混合物减压抽滤,先用去氧水洗3次,然后用少量乙醇、乙醚各洗涤3次,将产品铺于表面皿上,室温下干燥。用乙醇、乙醚洗涤的原因
(6)某实验室探究减少盐酸的用量对实验进行改进,实验结果如表。试分析实验①产率较低的原因
稀释浓盐酸后的实验结果对比
盐/g | /g | 去氧水 /m | 产品 颜色 | 剩余 Zn/g | 理论 产量/g | 实际 产量/g | 产率 /% | |||
| ①浓 ② ③ ④ ⑤ | 2.5 2.5 2.5 2.5 2.5 | 2.5 2.5 2.5 2.5 2.5 | 4 3 3 3 3 | 5 4 3 2 1 | 0 1 2 3 4 | 深红棕 红棕 砖红 砖红 砖红 | 2 1.4 1.7 2.1 2.4 | 1.76 1.76 1.76 1.76 1.76 | 1.01 1.31 1.44 1.50 1.61 | 57 74 82 85 91 |
2022·河北邢台·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网