解答题-实验探究题 适中0.65 引用11 组卷1422
硫化锂( )易潮解,加热条件下易被空气中的
)易潮解,加热条件下易被空气中的 氧化。某小组选择下列装置(装置可重复使用)制备
氧化。某小组选择下列装置(装置可重复使用)制备 。回答下列问题:
。回答下列问题:
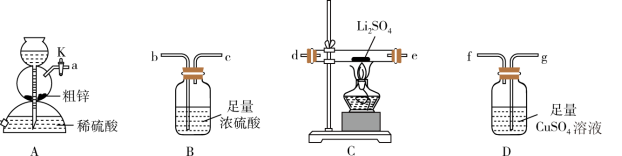
已知:①粗锌中含少量Cu和FeS;
②装置C中发生的反应为 。
。
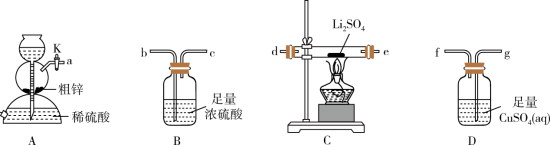
(1)装置A的名称是_______ ,停止装置A中反应的操作是_______ (填“打开”或“关闭”)K。
(2)气流从左至右,导管口连接顺序是a→_______ →_______ →_______ →_______ →d→e→_______ →_______ 。_______
(3)其他条件相同,粗锌与稀硫酸反应比纯锌_______ (填“快”或“慢”),实验中观察到装置D中产生黑色沉淀,其离子方程式为_______ 。
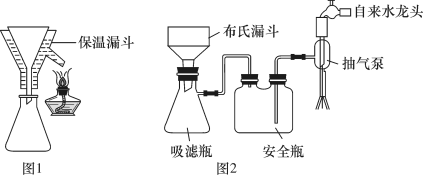
(4)实验完毕后,选择图1、图2装置对装置A中混合物进行分离。先选择图1装置过滤,再将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾( )。
)。
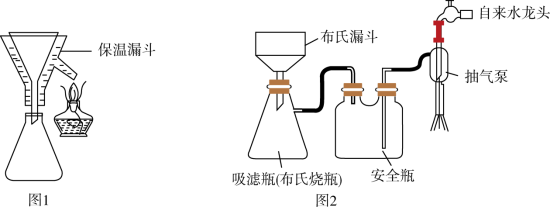
下列有关说法正确的是_______(填标号)。
(5)探究 产品成分:
产品成分:
①由实验Ⅱ知, 样品中还含有
样品中还含有_______ (填化学式),产生该杂质的可能原因是_______ (填标号)。
A.通入的氢气过量 B. 未反应完 C.温度过高
未反应完 C.温度过高
②测定产品纯度:向wg样品(设杂质只有 )中加入过量的
)中加入过量的 稀硫酸,充分反应后(设没有S单质生成),煮沸溶液以除去残留的酸性气体;滴加的酚酞溶液作指示剂,用标准
稀硫酸,充分反应后(设没有S单质生成),煮沸溶液以除去残留的酸性气体;滴加的酚酞溶液作指示剂,用标准 的NaOH溶液滴定过量的硫酸,消耗NaOH溶液
的NaOH溶液滴定过量的硫酸,消耗NaOH溶液 。
。 样品的纯度为
样品的纯度为_______ (列出计算式)。
已知:①粗锌中含少量Cu和FeS;
②装置C中发生的反应为

(1)装置A的名称是
(2)气流从左至右,导管口连接顺序是a→
(3)其他条件相同,粗锌与稀硫酸反应比纯锌
(4)实验完毕后,选择图1、图2装置对装置A中混合物进行分离。先选择图1装置过滤,再将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾(

下列有关说法正确的是_______(填标号)。
| A.选择图1装置过滤的优点是避免析出 |
| B.选择图1装置过滤,主要是分离 |
| C.粗皓矾中可能含胆矾 |
| D.选择图2装置过滤的优点是过滤速率快 |
| 实验 | 操作与现象 | 结论 |
| Ⅰ | 取少量 | 样品中含 |
| Ⅱ | 向实验Ⅰ的溶液中滴加 | 样品中含_______ |
A.通入的氢气过量 B.
②测定产品纯度:向wg样品(设杂质只有
2022·陕西榆林·三模
类题推荐  (硫化锂)是一种潜在的锂电池的电解质材料。某小组选择下列装置(装置B使用两次)利用氢气还原硫酸锂制备硫化锂。已知:
(硫化锂)是一种潜在的锂电池的电解质材料。某小组选择下列装置(装置B使用两次)利用氢气还原硫酸锂制备硫化锂。已知: 易潮解,在加热条件下易被空气中的
易潮解,在加热条件下易被空气中的 氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备
氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备 。
。
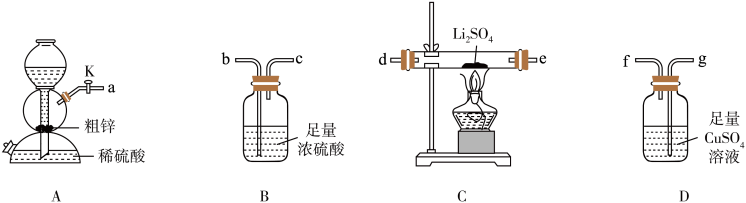
请回答下列问题:
(1)实验中装置C中有两种产物生成,请写出反应的化学方程式_______ 。
(2)按气流从左至右,装置的连接顺序是a→_______ (按气流方向,填小写字母,可重复利用)。
(3)利用装置A制氢气的主要优点是_______ ,还可用该装置制备的下列气体是_______ (填标号)。
A. :70%硫酸、亚硫酸钠粉末 B.
:70%硫酸、亚硫酸钠粉末 B. :稀盐酸、大理石
:稀盐酸、大理石
C. :浓氨水、生石灰 D.
:浓氨水、生石灰 D. :稀硫酸、硫化亚铁
:稀硫酸、硫化亚铁
(4)实验完毕后,采用图1、图2(夹持装置已略去)装置对装置A中混合物进行分离可得到副产物皓矾( )晶体。先选择图1装置进行过滤,并将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾晶体。
)晶体。先选择图1装置进行过滤,并将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾晶体。
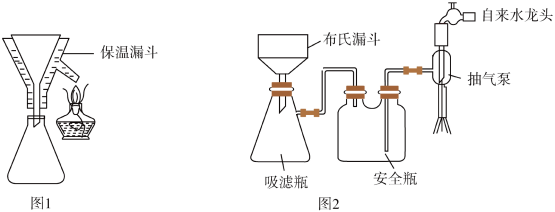
下列有关说法不正确的是_______(填标号)。
(5)欲探究 产品的成分,现进行如下实验:
产品的成分,现进行如下实验:
①由上述实验Ⅰ可知, 样品中含有
样品中含有_______ 杂质(填化学式)。
②测定产品纯度的方法:取wg 样品加入
样品加入 稀硫酸(过量)中,充分反应后,煮沸溶液以除去残留的酸性气体:滴加酚酞溶液作指示剂用
稀硫酸(过量)中,充分反应后,煮沸溶液以除去残留的酸性气体:滴加酚酞溶液作指示剂用 标准NaOH溶液滴定过量的硫酸,消耗NaOH溶液
标准NaOH溶液滴定过量的硫酸,消耗NaOH溶液 。若该
。若该 样品中杂质不参加反应,用上述方法测得的
样品中杂质不参加反应,用上述方法测得的 样品的纯度为
样品的纯度为_______ %(用含 、
、 、
、 、
、 、w的代数式表示)。
、w的代数式表示)。  (硫化锂)是一种潜在的锂电池的电解质材料。某小组选择下列装置(装置B使用两次)利用氢气还原硫酸锂制备硫化锂。已知:
(硫化锂)是一种潜在的锂电池的电解质材料。某小组选择下列装置(装置B使用两次)利用氢气还原硫酸锂制备硫化锂。已知: 易潮解,在加热条件下易被空气中的
易潮解,在加热条件下易被空气中的 氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备
氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备 。
。
请回答下列问题:
(1)实验中装置C中有两种产物生成,请写出反应的化学方程式___________ 。
(2)按气流从左至右,装置的连接顺序是a→___________ (按气流方向,填小写字母,可重复利用)。
(3)利用装置A制氢气的主要优点是___________ ,还可用该装置制备的下列气体是___________ (填标号)。
A. :70%硫酸、亚硫酸钠粉末 B.
:70%硫酸、亚硫酸钠粉末 B. :稀盐酸、大理石
:稀盐酸、大理石
C. :浓氨水、生石灰 D.
:浓氨水、生石灰 D. :稀硫酸、硫化亚铁
:稀硫酸、硫化亚铁
(4)实验完毕后,采用图1、图2(夹持装置已略去)装置对装置A中混合物进行分离可得到副产物皓矾 晶体。先选择图1装置进行过滤,并将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾晶体。
晶体。先选择图1装置进行过滤,并将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾晶体。
下列有关说法不正确的是___________(填标号)。
(5)欲探究 产品的成分,现进行如下实验:
产品的成分,现进行如下实验:
①由上述实验Ⅰ可知, 样品中含有
样品中含有___________ 杂质(填化学式),实验Ⅱ中存在 杂质的原因可能是
杂质的原因可能是___________ 。
②测定产品纯度的方法:取 样品加入
样品加入 稀硫酸(过量)中,充分反应后,煮沸溶液以除去残留的酸性气体;滴加酚酞溶液作指示剂,用
稀硫酸(过量)中,充分反应后,煮沸溶液以除去残留的酸性气体;滴加酚酞溶液作指示剂,用 标准NaOH溶液滴定过量的硫酸,消耗NaOH溶液
标准NaOH溶液滴定过量的硫酸,消耗NaOH溶液 。若该
。若该 样品中杂质不参加反应,用上述方法测得的
样品中杂质不参加反应,用上述方法测得的 样品的纯度为
样品的纯度为___________ %(用含 、
、 、
、 、
、 、w的代数式表示)。
、w的代数式表示)。
Li2S(硫化锂)是一种潜在的锂电池的电解质材料。某小组选择下列装置(装置B使用两次)利用氢气还原硫酸锂制备硫化锂,原理是Li2SO4+4H2 Li2S+4H2O。已知:Li2S易潮解,在加热条件下易被空气中的O2氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备H2。
Li2S+4H2O。已知:Li2S易潮解,在加热条件下易被空气中的O2氧化。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备H2。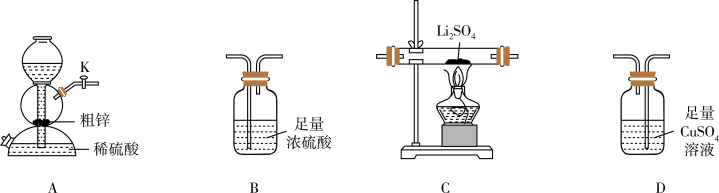
请回答下列问题:
(1)按气流从左至右,装置的连接顺序是A→____ (填字母)。
(2)其他条件相同,粗锌与稀硫酸反应比纯锌____ (填“快”或“慢”)。实验中观察到装置D中产生黑色沉淀,其离子方程式为____ 。
(3)还可利用装置A制备的下列气体是____ (填字母)。
A.SO2:70%硫酸、亚硫酸钠粉末
B.CO2:稀盐酸、大理石
C.Cl2:浓盐酸、二氧化锰
(4)实验完毕后,采用图1、图2(夹持装置已略去)装置对装置A中混合物进行分离可得到副产物皓矾(ZnSO4·7H2O)晶体。先选择图1装置进行过滤,并将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾晶体。
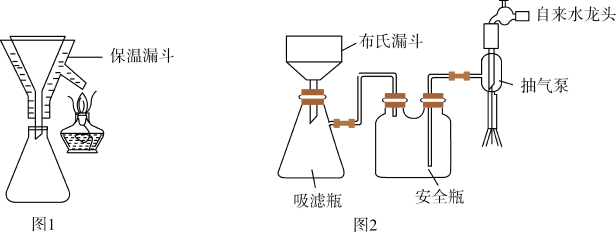
下列有关说法正确的是____ (填字母)。
(5)欲探究Li2S产品的成分,现进行如表实验:
①由上述实验II可知,Li2S样品中含有____ 杂质(填化学式),产生该杂质的原因可能是____ 。
②测定产品纯度的方法:取wgLi2S样品加入V1mLc1mol·L-1稀硫酸(过量)中,充分反应后,煮沸溶液以除去残留的酸性气体;滴加酚酞溶液作指示剂,用c2mol·L-1标准NaOH溶液滴定过量的硫酸,消耗NaOH溶液V2mL。若该Li2S样品中杂质不参加反应,用上述方法测得的Li2S样品的纯度为____ %(用含V1、V2、c1、c2、w的代数式表示)。

请回答下列问题:
(1)按气流从左至右,装置的连接顺序是A→
(2)其他条件相同,粗锌与稀硫酸反应比纯锌
(3)还可利用装置A制备的下列气体是
A.SO2:70%硫酸、亚硫酸钠粉末
B.CO2:稀盐酸、大理石
C.Cl2:浓盐酸、二氧化锰
(4)实验完毕后,采用图1、图2(夹持装置已略去)装置对装置A中混合物进行分离可得到副产物皓矾(ZnSO4·7H2O)晶体。先选择图1装置进行过滤,并将滤液进行蒸发浓缩、降温结晶,再选择图2装置过滤,得到粗皓矾晶体。

下列有关说法正确的是
| A.采用图1装置过滤的优点是避免析出ZnSO4·7H2O |
| B.采用图1装置过滤主要是分离FeSO4·7H2O和ZnSO4溶液 |
| C.粗皓矾晶体中可能含少量CuSO4·5H2O杂质 |
| D.采用图2装置过滤的优点是过滤速度快 |
| 实验 | 操作与现象 | 结论 |
| I | 取少量Li2S样品,滴加足量的稀盐酸,将气体通入品红溶液中,溶液褪色 | 样品含Li2SO3 |
| II | 在实验I的溶液中滴加BaCl2溶液,产生白色沉淀 | 样品含 |
②测定产品纯度的方法:取wgLi2S样品加入V1mLc1mol·L-1稀硫酸(过量)中,充分反应后,煮沸溶液以除去残留的酸性气体;滴加酚酞溶液作指示剂,用c2mol·L-1标准NaOH溶液滴定过量的硫酸,消耗NaOH溶液V2mL。若该Li2S样品中杂质不参加反应,用上述方法测得的Li2S样品的纯度为

请回答下列问题:
(1)实验中装置C中有两种产物生成,请写出反应的化学方程式
(2)按气流从左至右,装置的连接顺序是a→
(3)利用装置A制氢气的主要优点是
A.
C.
(4)实验完毕后,采用图1、图2(夹持装置已略去)装置对装置A中混合物进行分离可得到副产物皓矾(

下列有关说法不正确的是_______(填标号)。
| A.采用图1装置过滤的优点是避免析出 |
| B.采用图1装置过滤主要是分离 |
| C.粗皓矾晶体中可能含少量 |
| D.采用图2装置过滤的优点是过滤速度快 |
| 实验 | 操作与现象 | 结论 |
| Ⅰ | 取少量 | 样品含_______ |
| Ⅱ | 在实验Ⅰ的溶液中滴加 | 样品含 |
②测定产品纯度的方法:取wg

请回答下列问题:
(1)实验中装置C中有两种产物生成,请写出反应的化学方程式
(2)按气流从左至右,装置的连接顺序是a→
(3)利用装置A制氢气的主要优点是
A.
C.
(4)实验完毕后,采用图1、图2(夹持装置已略去)装置对装置A中混合物进行分离可得到副产物皓矾

下列有关说法不正确的是___________(填标号)。
| A.采用图1装置过滤的优点是避免析出 |
| B.采用图1装置过滤主要是分离 |
| C.粗皓矾晶体中可能含少量 |
| D.采用图2装置过滤的优点是过滤速度快 |
| 实验 | 操作与现象 | 结论 |
| Ⅰ | 取少量 | 样品含___________ |
| Ⅱ | 在实验Ⅰ的溶液中滴加 | 样品含 |
②测定产品纯度的方法:取
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


