解答题-实验探究题 适中0.65 引用2 组卷345
在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现新期特的物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率。
(1)控制条件,让反应在恒容密闭容器中进行如下反应: 。用传感器测得不同时间NO和CO的浓度如表。
。用传感器测得不同时间NO和CO的浓度如表。
前2s内的平均反应速率 =
=_______ ,从表格看,已达化学平衡的时间段为:_______ 。
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的 气体后,发生反应
气体后,发生反应
 ,已知
,已知 是红棕色气体,
是红棕色气体, 是无色气体。反应速率(v)与时间(t)的关系曲线。下列叙述正确的是
是无色气体。反应速率(v)与时间(t)的关系曲线。下列叙述正确的是_______ 。
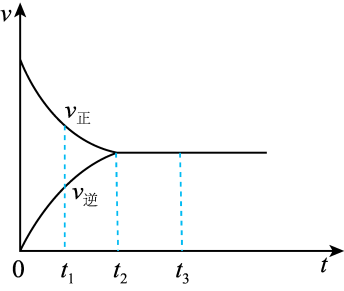
a. 时,反应未达到平衡,
时,反应未达到平衡, 浓度在减小
浓度在减小
b. 时,反应达到平衡,反应不再进行
时,反应达到平衡,反应不再进行
c. 各物质浓度不再变化
各物质浓度不再变化
d. 各物质浓度相等
各物质浓度相等
e. ,
, 浓度增大
浓度增大
f.反应过程中气体的颜色不变
g.建立平衡过程中,混合气体平均相对分子质量增大
(3)在压强为0.1MPa条件下,amol CO与3a mol 的混合气体在催化剂作用下能自发反应生成甲醇:
的混合气体在催化剂作用下能自发反应生成甲醇: 放热。为了寻得合成甲醇的适宜温度与压强,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。表中剩余的实验数据:
放热。为了寻得合成甲醇的适宜温度与压强,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。表中剩余的实验数据:
_______ ,
_______ 。
(4)比较相同浓度的 溶液和不同浓度的
溶液和不同浓度的 溶液反应的反应快慢可通过测定
溶液反应的反应快慢可通过测定_______ 来实现。
(5)在四个不同的容器中,在不同的条件下进行合成氨反应: 根据在相同时间内测定的结果判断,生成氨气的反应速率由大到小排列_______
根据在相同时间内测定的结果判断,生成氨气的反应速率由大到小排列_______
(1)控制条件,让反应在恒容密闭容器中进行如下反应:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 | |
| 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的

a.
b.
c.
d.
e.
f.反应过程中气体的颜色不变
g.建立平衡过程中,混合气体平均相对分子质量增大
(3)在压强为0.1MPa条件下,amol CO与3a mol
| 实验编号 | T(℃) | P(MPa) | |
| ① | 180 | 2∶3 | 0.1 |
| ② | n | 2∶3 | 5 |
| ③ | 350 | m | 5 |
(5)在四个不同的容器中,在不同的条件下进行合成氨反应:
| A. | B. |
| C. | D. |
21-22高一下·广东广州·期中
类题推荐
I、为了模拟汽车尾气在催化转化器内的工作情况:
(1)控制条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)⇌ N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如表:
前2s内的平均反应速率v(N2)=____ ,从表格看,达到化学平衡的时间段为:____
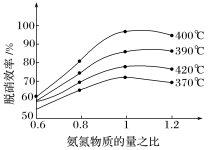
(2)用氨气催化氧化还原法脱硝(NOx):根据如图(纵坐标是脱硝效率、横坐标为氨氮物质的量之比),判断提高脱硝效率的最佳条件是:____ 。
(3)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是____ 。
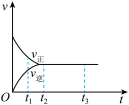
a.t1时,反应未达到平衡,NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
g.建立平衡过程中,混合气体平均相对分子质量增大
Ⅱ、甲醇是一种很好的燃料
(1)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(l)放热。为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了面的实验设计表中.
表中剩余的实验数据:n=____ ,m=____ .
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。下列说法不正确的是____ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
④负极反应式为CH3OH+8OH--6e-=CO32-+6H2O
(3)某反应2A⇌B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如表所示。

①在实验2中,A的初始浓度c2=____ mol·L-1。
②设实验3的反应速率为v3,实验1的反应速率为v1,则v3____ vl(填“>”、“="或“<”)。
(1)控制条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)⇌ N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
前2s内的平均反应速率v(N2)=
(2)用氨气催化氧化还原法脱硝(NOx):根据如图(纵坐标是脱硝效率、横坐标为氨氮物质的量之比),判断提高脱硝效率的最佳条件是:

(3)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是

a.t1时,反应未达到平衡,NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
g.建立平衡过程中,混合气体平均相对分子质量增大
Ⅱ、甲醇是一种很好的燃料
(1)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(l)放热。为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了面的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| ① | 180 | 2:3 | 0.1 |
| ② | n | 2:3 | 5 |
| ③ | 350 | m | 5 |
表中剩余的实验数据:n=
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。下列说法不正确的是
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
④负极反应式为CH3OH+8OH--6e-=CO32-+6H2O
(3)某反应2A⇌B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如表所示。

①在实验2中,A的初始浓度c2=
②设实验3的反应速率为v3,实验1的反应速率为v1,则v3
在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现所期待的物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率。
(1)控制条件,让反应在恒容密闭穼器中进行反应: 。用传感器测得不同时间
。用传感器测得不同时间 和
和 的浓度如表。
的浓度如表。
前 内的平均反应速率
内的平均反应速率
___________ ,从表格看,已达化学平衡的时间段为___________ s;
(2)在一定温度下,某固定容积的密闭容器中充入一定量的 气体后,发生反应
气体后,发生反应 ,已知
,已知 是红棕色气体,
是红棕色气体, 是无色气体。如图所示是反应速率(
是无色气体。如图所示是反应速率( 与时间
与时间 的关系曲线。下列叙述正确的是
的关系曲线。下列叙述正确的是___________ ;

a. 时,反应未达到平衡,
时,反应未达到平衡, 浓度在减小
浓度在减小
b. 时,反应达到平衡,反应不再进行
时,反应达到平衡,反应不再进行
c. 各物质浓度不再变化
各物质浓度不再变化
d. 各物质浓度相等
各物质浓度相等
e. ,
, 浓度增大
浓度增大
f.反应过程中气体的颜色不变
(3)使用 时也要注意防止污染环境。电化学气敏传感器可用于监测环境中
时也要注意防止污染环境。电化学气敏传感器可用于监测环境中 的含量,其工作原理如图:
的含量,其工作原理如图:

①Pt电极(b)上的电极反应式为___________ ;
②电池总反应的化学反应方程式为___________ ,反应一段时间后, 溶液的浓度将
溶液的浓度将___________ (填“增大”“减小”或“不变”)。
(1)控制条件,让反应在恒容密闭穼器中进行反应:
| 时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 | |
| 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)在一定温度下,某固定容积的密闭容器中充入一定量的

a.
b.
c.
d.
e.
f.反应过程中气体的颜色不变
(3)使用

①Pt电极(b)上的电极反应式为
②电池总反应的化学反应方程式为
汽车尾气中的主要污染物是NO和CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g) △H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=________ kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
①c1合理的数值为______ 。(填字母标号)
A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率v(CO2)=________ 。
③不能作为判断该反应达到平衡状态的标志是___________ 。(填字母标号)
a.
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
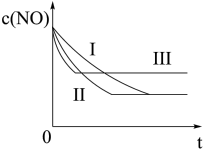
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为______________ 。
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体。某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=______________ 。
(5)CO可作燃料电池的燃气。用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650℃下工作的燃料电池。该电池总反应方程式为2CO+O2=2CO2则负极反应式为__________________________________ 。
(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g) △H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率v(CO2)=
③不能作为判断该反应达到平衡状态的标志是
a.
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:

| 实验 编号 | T/℃ | NO初始浓 度/10-3mol·L-1 | CO初始浓 度/10-3mol·L-1 | 催化剂的比 表面积/m2·g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体。某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K=
(5)CO可作燃料电池的燃气。用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650℃下工作的燃料电池。该电池总反应方程式为2CO+O2=2CO2则负极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


