解答题-原理综合题 适中0.65 引用1 组卷31
碳中和是目前全球关注的热点。将 加氢转化为甲醇是一种有效利用
加氢转化为甲醇是一种有效利用 的方式之一,回答下列问题:
的方式之一,回答下列问题:
(1)已知:
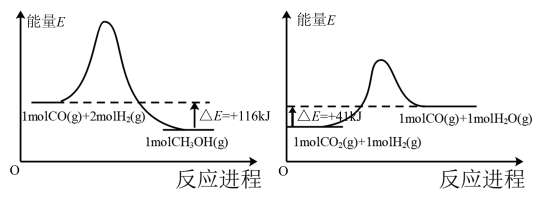
反应 的
的
_______  。
。
(2)实验室在1L密闭容器中进行模拟合成实验。将 和
和 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L)
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L)
反应Ⅰ: (主反应)
(主反应)
反应Ⅱ:
①反应开始10min内, 的平均反应速率为
的平均反应速率为_______ 。
②该温度下,反应 的平衡常数
的平衡常数
_______ 
③500℃时,将容器的容积压缩到原来的一半,在其他条件不变的情况下,平衡体系中变化正确的是_______ (填标号)。
A. 减小
减小
B.反应Ⅰ正反应速率加快,逆反应速率减慢
C. 的物质的量增加
的物质的量增加
D.重新平衡时, 比值增大
比值增大
(3)在上述模拟合成实验中,测得不同温度下的 平衡转化率如下表所示:
平衡转化率如下表所示:
 平衡转化率先减小后增大的原因是
平衡转化率先减小后增大的原因是_______ 。
(1)已知:

反应
(2)实验室在1L密闭容器中进行模拟合成实验。将
| 物质/时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 0.40 | 0.55 | 0.65 | 0.73 | 0.80 | 0.80 | |
| 0.45 | 0.63 | 0.78 | 0.86 | 0.90 | 0.90 |
反应Ⅰ:
反应Ⅱ:
①反应开始10min内,
②该温度下,反应
③500℃时,将容器的容积压缩到原来的一半,在其他条件不变的情况下,平衡体系中变化正确的是
A.
B.反应Ⅰ正反应速率加快,逆反应速率减慢
C.
D.重新平衡时,
(3)在上述模拟合成实验中,测得不同温度下的
| T/℃ | 300 | 500 | 700 |
| 93 | 90 | 92 |
21-22高二下·安徽滁州·期中
类题推荐
碳中和是目前全球关注的热点。研发利用CO2成为目前的研究热点。将CO2加氢转化为甲醇是一种有效利用CO2的方式之一。
(1)已知:
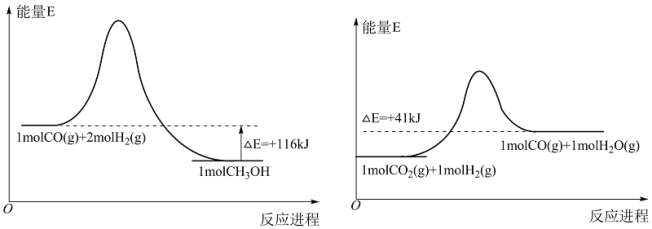
由上述反应,可知CO2(g)+3H2(g) CH3OH(g)+H2O(g)的△H=
CH3OH(g)+H2O(g)的△H=______ mol∙L−1。
(2)实验室在1L密闭容器中进行模拟合成实验。将1molCO2和3molH2通入容器中,在催化剂的作用下,恒温500°C反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol∙L−1)
I.反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) (主反应);
CH3OH(g)+H2O(g) (主反应);
II.反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
①反应开始10分钟内,H2的平均反应速率为___________ ;
②该温度下,CO2(g)+3H2(g) CH3OH(g)+H2O(g)平衡常数K的数值为
CH3OH(g)+H2O(g)平衡常数K的数值为___________ ;
③500°C时,将容器的容积压缩到原来的一半,在其他条件不变的情况下,平衡体系中变化正确的是___________ 。
a.c(H2)减小
b.I反应正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时 比值增大
比值增大
(3)在上述模拟合成实验中,在催化剂的作用下,测定不同温度下,CO2平衡转化率与甲醇的选择性的关系如下表所示:
注:甲醇的选择性指反应中CO2转化为甲醇的百分比
请解释说明CO2平衡转化率先降低后升高的原因___________ ,并解释甲醇的选择性先升高后降低的原因___________ 。
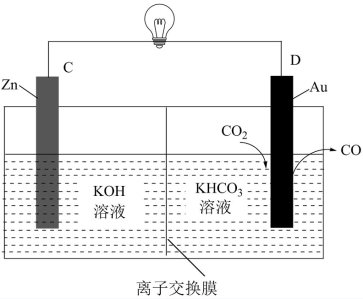
(4)金属−CO2电池同样是一种有效利用CO2的方式之一,福建物构所王要兵教授团队研究出可充电的水系Zn−CO2电池。根据电池示意图,电解质溶液均参与对应的电极反应,请写出放电时电池正极反应:___________ 。
(1)已知:

由上述反应,可知CO2(g)+3H2(g)
(2)实验室在1L密闭容器中进行模拟合成实验。将1molCO2和3molH2通入容器中,在催化剂的作用下,恒温500°C反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol∙L−1)
I.反应:CO2(g)+3H2(g)
II.反应:CO2(g)+H2(g)
| 物质\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| CH3OH(g) | 0.40 | 0.55 | 0.65 | 0.73 | 0.80 | 0.80 |
| H2O(g) | 0.45 | 0.63 | 0.78 | 0.86 | 0.90 | 0.90 |
②该温度下,CO2(g)+3H2(g)
③500°C时,将容器的容积压缩到原来的一半,在其他条件不变的情况下,平衡体系中变化正确的是
a.c(H2)减小
b.I反应正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时
(3)在上述模拟合成实验中,在催化剂的作用下,测定不同温度下,CO2平衡转化率与甲醇的选择性的关系如下表所示:
| T/°C | 300 | 500 | 700 |
| CO2平衡转化率/% | 93 | 90 | 92 |
| 甲醇的选择性/% | 83.6 | 88.9 | 73.1 |
请解释说明CO2平衡转化率先降低后升高的原因
(4)金属−CO2电池同样是一种有效利用CO2的方式之一,福建物构所王要兵教授团队研究出可充电的水系Zn−CO2电池。根据电池示意图,电解质溶液均参与对应的电极反应,请写出放电时电池正极反应:

碳中和是目前全球关注的热点。将 捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用
捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用 的方式。
的方式。
Ⅰ.实验室模拟由 与
与 合成甲醇。
合成甲醇。
(1)已知:
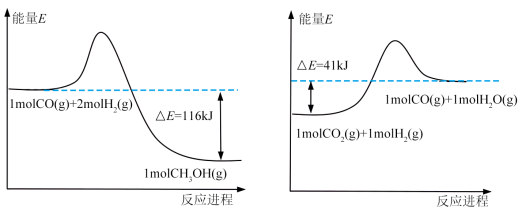
由上图反应,可知 的
的
_________  。
。
(2)实验室在1L密闭容器中进行模拟合成实验。将1mol 和3mol
和3mol 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
反应1: (主反应);
(主反应);
反应2:
①下列说法正确的是_________ 。(填字母代号)。
A.容器内气体的密度不再改变,说明达到平衡状态
B.容器内气体的平均相对分子质量不再改变,说明达到平衡状态
C.压缩容器体积使压强增大,有利于主反应的发生
D.升高体系温度有利于主反应发生
②反应0~50min内, 的平均反应速率为
的平均反应速率为_________  ;
;
③该温度下, 平衡常数K为
平衡常数K为_________ 。
Ⅱ.中国科学家通过电还原法将 转化为乙醇,其原理图如下所示。
转化为乙醇,其原理图如下所示。
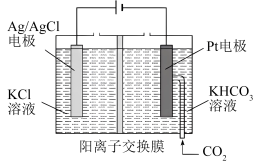
(3)则铂电极上的反应式为_________ 。
Ⅲ. 与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
(4)该反应化学方程式为_________ ,反应中常加入吸水剂,其目的是_________ 。
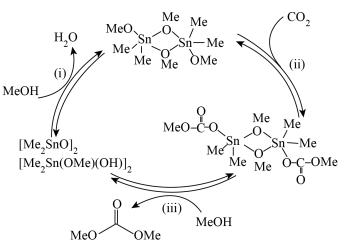
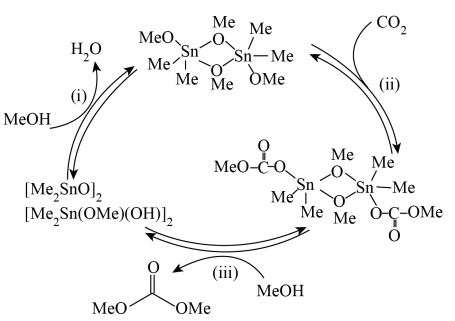
(5)下图表示的是甲醇(Me表示 )与
)与 催化制备碳酸二甲酯的机理,按(ⅰ)(ⅱ)(ⅲ)步骤循环反应。图中
催化制备碳酸二甲酯的机理,按(ⅰ)(ⅱ)(ⅲ)步骤循环反应。图中 分子中只有一种类型的Me,该分子结构式为
分子中只有一种类型的Me,该分子结构式为_________ ( 用Me表示)
用Me表示)
Ⅰ.实验室模拟由
(1)已知:

由上图反应,可知
(2)实验室在1L密闭容器中进行模拟合成实验。将1mol
反应1:
反应2:
| 物质\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 0.40 | 0.55 | 0.65 | 0.73 | 0.80 | 0.80 | |
| 0.45 | 0.63 | 0.78 | 0.86 | 0.90 | 0.90 |
A.容器内气体的密度不再改变,说明达到平衡状态
B.容器内气体的平均相对分子质量不再改变,说明达到平衡状态
C.压缩容器体积使压强增大,有利于主反应的发生
D.升高体系温度有利于主反应发生
②反应0~50min内,
③该温度下,
Ⅱ.中国科学家通过电还原法将

(3)则铂电极上的反应式为
Ⅲ.
(4)该反应化学方程式为
(5)下图表示的是甲醇(Me表示

碳中和是目前全球关注的热点。将 捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用
捕获转化为甲醇、乙醇和碳酸二甲酯等是有效利用 的方式。
的方式。
Ⅰ.实验室模拟由 与
与 合成甲醇。
合成甲醇。
(1)已知:
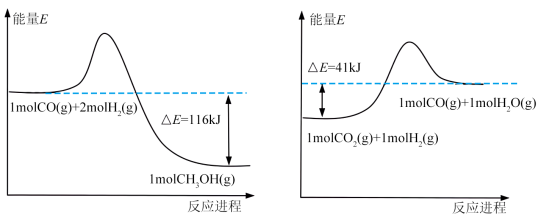
由上图反应,可知 的
的
_______  。
。
(2)实验室在1L密闭容器中进行模拟合成实验。将 和
和 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:
反应1: (主反应);
(主反应);
反应2:
①下列说法正确的是_______ 。(填字母代号)。
A.容器内气体的密度不再改变,说明达到平衡状态
B.容器内气体的平均相对分子质量不再改变,说明达到平衡状态
C.压缩容器体积使压强增大,有利于主反应的发生
D.升高体系温度有利于主反应发生
②反应0~50min内, 的平均反应速率为
的平均反应速率为_______  ;
;
③该温度下, 平衡常数K为
平衡常数K为_______ 。
Ⅱ.中国科学家通过电还原法将 转化为乙醇,其原理图如下所示。
转化为乙醇,其原理图如下所示。
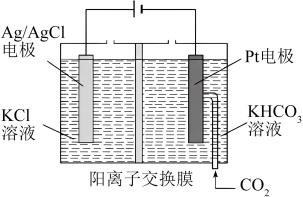
(3)则铂电极上的反应式为_______ 。
Ⅲ. 与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
与甲醇可以在一定条件下合成碳酸二甲酯,回答下列问题。
(4)该反应化学方程式为_______ ,反应中常加入吸水剂,其目的是_______ 。
(5)图表示的是甲醇(Me表示 )与
)与 催化制备碳酸二甲酯的机理,按(i)(ii)(iii)步骤循环反应。图中
催化制备碳酸二甲酯的机理,按(i)(ii)(iii)步骤循环反应。图中 分子中只有一种类型的Me,该分子结构式为
分子中只有一种类型的Me,该分子结构式为_______ ( 用Me表示)
用Me表示)
Ⅰ.实验室模拟由
(1)已知:

由上图反应,可知
(2)实验室在1L密闭容器中进行模拟合成实验。将
反应1:
反应2:
| 物质\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 0.40 | 0.55 | 0.65 | 0.73 | 0.80 | 0.80 | |
| 0.45 | 0.63 | 0.78 | 0.86 | 0.90 | 0.90 |
A.容器内气体的密度不再改变,说明达到平衡状态
B.容器内气体的平均相对分子质量不再改变,说明达到平衡状态
C.压缩容器体积使压强增大,有利于主反应的发生
D.升高体系温度有利于主反应发生
②反应0~50min内,
③该温度下,
Ⅱ.中国科学家通过电还原法将

(3)则铂电极上的反应式为
Ⅲ.
(4)该反应化学方程式为
(5)图表示的是甲醇(Me表示

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


