解答题-工业流程题 适中0.65 引用1 组卷70
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
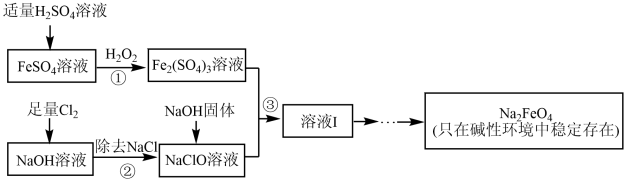
(1)高铁酸钠中铁元素的化合价为_______ ,次氯酸钠的电子式是_______ 。
(2)铁元素位于元素周期表的第四周期第VIII族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是_______ 。
(3)步骤①反应的离子方程式是_______ 。
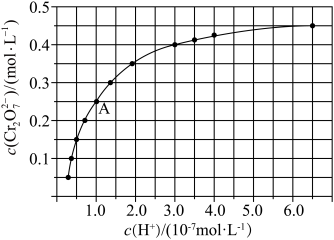
(4)工业废水中常含有一定量的 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将 转化为Cr3+,再将Cr3+转化为沉淀。利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理
转化为Cr3+,再将Cr3+转化为沉淀。利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_______ 。
(5)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_______ 。
(6)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3与NaOH反应的方程式_______ 。

(1)高铁酸钠中铁元素的化合价为
(2)铁元素位于元素周期表的第四周期第VIII族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是
(3)步骤①反应的离子方程式是
(4)工业废水中常含有一定量的
(5)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为
(6)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3与NaOH反应的方程式
21-22高二下·四川泸州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网