解答题-原理综合题 适中0.65 引用1 组卷100
氨、硫酸都是重要的工业原料,根据题意完成下列各题。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为_______ 。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为_______ 。
(3)将硫酸工业尾气中的SO2转化成硫酸,同时获得电能。装置如图所示(电极均为惰性材料):
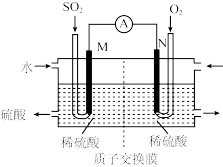
①原电池的负极为_______ 。(填“M”或“N”)
②M极发生的电极反应式为_______ 。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为
(3)将硫酸工业尾气中的SO2转化成硫酸,同时获得电能。装置如图所示(电极均为惰性材料):

①原电池的负极为
②M极发生的电极反应式为
21-22高一下·四川泸州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网