解答题-原理综合题 适中0.65 引用1 组卷132
2022年3月4日,全球首套1000吨/年二氧化碳加氢制汽油中试装置,在山东邹城工业园区开车成功,生产出符合国Ⅵ标准的清洁汽油产品。 转化过程如图1:
转化过程如图1:
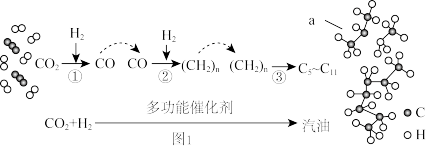
(1)写出反应①的化学方程式_______
(2)一定温度下,向2L的密闭容器中加入一定量的 气体发生反应①,产物均为气态。反应过程中
气体发生反应①,产物均为气态。反应过程中 气体和CO气体的物质的量与时间的关系如图2所示。回答下列问题:
气体和CO气体的物质的量与时间的关系如图2所示。回答下列问题:
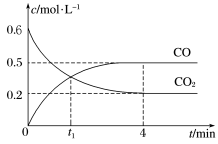
图2
①t1min时,正、逆反应速率的大小关系为v正_______ v逆 (填“>”“<”或“=”)。
② 内,
内, 的的平均反应速率为
的的平均反应速率为_______ 。
③判断该反应达到平衡状态的依据是_______ (填序号)
A. 和CO气体的浓度相等
和CO气体的浓度相等
B.混合气体的总物质的量不再改变
C.单位时间内 的消耗量等于CO的消耗量
的消耗量等于CO的消耗量
D.混合气体的密度不随时间变化
④能加快反应速率的措施任写两条_______ 。
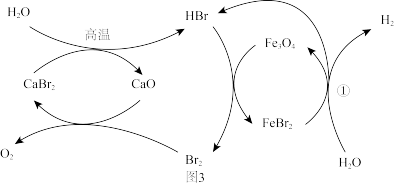
(3)原料氢气,采用 为原料进行气固相反应实现水的分解制得,其反应原理如图3所示。可以循环利用的物质有
为原料进行气固相反应实现水的分解制得,其反应原理如图3所示。可以循环利用的物质有_______ 。
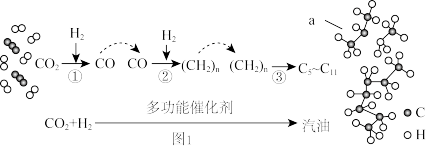
(1)写出反应①的化学方程式
(2)一定温度下,向2L的密闭容器中加入一定量的

图2
①t1min时,正、逆反应速率的大小关系为v正
②
③判断该反应达到平衡状态的依据是
A.
B.混合气体的总物质的量不再改变
C.单位时间内
D.混合气体的密度不随时间变化
④能加快反应速率的措施任写两条
(3)原料氢气,采用

21-22高一下·山东济宁·期中
类题推荐
Ⅰ.甲醇是一种高效清洁的新能源,已知在常温常压下:




(1)则

___________  。
。
Ⅱ.在恒温恒容的密闭容器中,工业上常用反应①: 制备甲醇;其中的原料气常用反应②:
制备甲醇;其中的原料气常用反应②: 来制备。根据题意完成下列各题:
来制备。根据题意完成下列各题:
(2)判断反应①达到平衡状态的标志是___________ (填字母)。
A.容器中气体的压强不变
B.CO和 浓度相等
浓度相等
C.V消耗 生成(CO)
生成(CO)
D.容器中混合气体的密度保持不变
E.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO的转化率,下列措施可行的是___________(填字母)。
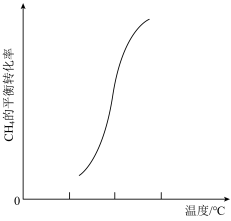
(4)一定条件下,反应②中 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
___________ 0(填“<”、“>”或“=”),在T°C时的10L密闭容器中,充入 和
和 发生反应②,经过5min达到平衡,此时
发生反应②,经过5min达到平衡,此时 的转化率为50%,则从开始到平衡,
的转化率为50%,则从开始到平衡, 的平均反应速率为
的平均反应速率为___________ 。若向此10L密闭容器中,加入 、
、 、
、 、和
、和 发生反应②,若温度仍为T°C,此时V(正)
发生反应②,若温度仍为T°C,此时V(正)___________ V(逆)(填“<”、“>”或“=”)。
(5)若某温度下,将 和
和 加入压强为200kPa的恒压密闭容器中发生反应②,正反应速率
加入压强为200kPa的恒压密闭容器中发生反应②,正反应速率 ,逆反应速率
,逆反应速率 ,P为分压(分压=总压×物质的量分数),则该反应的压强平衡常数
,P为分压(分压=总压×物质的量分数),则该反应的压强平衡常数
___________ (以 、
、 表示)。若
表示)。若 ,当
,当 消耗20%时,
消耗20%时,
___________  (保留两位有效数字)
(保留两位有效数字)
(1)则
Ⅱ.在恒温恒容的密闭容器中,工业上常用反应①:
(2)判断反应①达到平衡状态的标志是
A.容器中气体的压强不变
B.CO和
C.V消耗
D.容器中混合气体的密度保持不变
E.混合气体的平均相对分子质量不发生变化
(3)欲提高反应①中CO的转化率,下列措施可行的是___________(填字母)。
| A.减小容器容积 | B.升高温度 |
| C.向装置中再充入He | D.向装置中再充入 |
(4)一定条件下,反应②中
(5)若某温度下,将
甲醇是重要的化工原料,利用合成气(CO、 、
、 )在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol
)在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol  和3.0 mol
和3.0 mol  ,在一定条件下发生反应:
,在一定条件下发生反应: ,测得
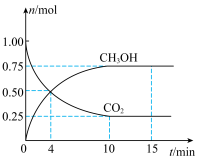
,测得 和
和 的物质的量随时间的变化如图所示。回答下列问题:
的物质的量随时间的变化如图所示。回答下列问题:___________ mol⋅L ⋅min
⋅min ,此时v(正)
,此时v(正)___________ v(逆)(填“>”“<”或“=”)。
②下列措施能增大反应速率的是___________ (填字母)。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(2)反应达到平衡时, 的转化率为
的转化率为___________ , 的体积分数为
的体积分数为___________ 。
(3)下列描述中能说明上述反应达到平衡状态的是___________(填字母)。
(4)化石燃料燃烧产生的 是主要的温室气体之一,使用电化学方法能够对
是主要的温室气体之一,使用电化学方法能够对 进行吸收。利用活泼金属与
进行吸收。利用活泼金属与 的反应,能够构建金属
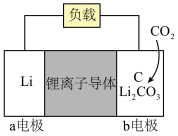
的反应,能够构建金属 电池。其中一种
电池。其中一种 电池的模型如下图所示(图中
电池的模型如下图所示(图中 是固体):
是固体):___________ (填“正”或“负”)极,正极电极反应式为___________ 。
②该电池中每转移2 mol电子,能够吸收___________ mol  。
。
②下列措施能增大反应速率的是
A.升高温度 B.降低压强 C.减小
(2)反应达到平衡时,
(3)下列描述中能说明上述反应达到平衡状态的是___________(填字母)。
| A. |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总压强不随时间的变化而变化 |
| D.单位时间内消耗3 mol |
(4)化石燃料燃烧产生的
②该电池中每转移2 mol电子,能够吸收
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 NH2COONH4(s) ΔH1
NH2COONH4(s) ΔH1