解答题-实验探究题 较难0.4 引用2 组卷433
碳酸氢钠是一种无机盐,在制药工业、食品加工、消防器材等方面有广泛的应用。
I.
(1)写出侯氏制碱法过程中得到碳酸氢钠的化学方程式_______ 。
(2)25℃时,H2CO3电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。已知NaHCO3溶液存在2 ⇌
⇌ +H2CO3,则该反应的平衡常数值为
+H2CO3,则该反应的平衡常数值为_______ (保留3位有效数字)。
II.某化学实验小组发现镁和NaHCO3溶液反应比镁和水反应速率快,通过实验探究速率加快原因和产物成分。
(3)速率加快的原因探究
小组同学为研究速率加快可能的原因,分别取0.1g打磨的镁条进行了如下实验
已知:Mg和H2O反应只能在Mg表面产生微量气泡, 在中性或碱性条件下不与镁反应。设计实验组2的目的是
在中性或碱性条件下不与镁反应。设计实验组2的目的是_______ ,为控制变量与实验组1一致,应对实验组2进行改进,具体操作为_______ 。镁和NaHCO3溶液反应比镁和水反应速率快的原因可能是_______ 。
(4)产物成分探究
①将产生的气体点燃有蓝色火焰,通入澄清的石灰水变浑浊,则推测气体成分为H2和CO2。
②某同学认为逸出的气体会带出少量溶液也能使澄清石灰水变浑浊。于是在密闭容器中利用CO2传感器测定15分钟三组不同情况下CO2气体浓度变化。
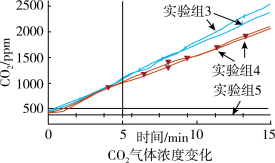
测量时取少量NaHCO3溶液、少量镁条的原因是_______ ;通过图象可以确定镁和NaHCO3溶液反应生成的气体为_______ 。
I.
(1)写出侯氏制碱法过程中得到碳酸氢钠的化学方程式
(2)25℃时,H2CO3电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。已知NaHCO3溶液存在2
II.某化学实验小组发现镁和NaHCO3溶液反应比镁和水反应速率快,通过实验探究速率加快原因和产物成分。
(3)速率加快的原因探究
小组同学为研究速率加快可能的原因,分别取0.1g打磨的镁条进行了如下实验
| 实验组1 | 6mLlmol/LNaHCO3溶液(pH=8.4) | 持续产生大量气泡,溶液略显浑浊 |
| 实验组2 | 6mLlmol/LNaNO3溶液 | 镁表面微量气泡附着 |
(4)产物成分探究
①将产生的气体点燃有蓝色火焰,通入澄清的石灰水变浑浊,则推测气体成分为H2和CO2。
②某同学认为逸出的气体会带出少量溶液也能使澄清石灰水变浑浊。于是在密闭容器中利用CO2传感器测定15分钟三组不同情况下CO2气体浓度变化。
| 实验组3 | 6mL1mol/LNaHCO3溶液加入250mL塑料瓶,但不加入镁条 |
| 实验组4 | 6mL1mol/LNaHCO3溶液加入250mL塑料瓶,并加入0.1g打磨的镁条 |
| 实验组5 | 空塑料瓶 |

测量时取少量NaHCO3溶液、少量镁条的原因是
2022·全国·二模
类题推荐
Ⅰ.为确定 催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如表。
催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如表。
分析表中数据回答下列问题:
(1)相同浓度的过氧化氢的分解速率随着 用量的增加而
用量的增加而_______ (填“加快”、“减慢”或“不变)。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入_______ g的 为较佳选择。
为较佳选择。
(3)该小组的某同学分析上述数据后得出:“当用相同质量的 时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?
时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?_______ (填“正确”或“不正确”),理由是_______ (提示: 溶液的密度可认为近似相等)。
溶液的密度可认为近似相等)。
Ⅱ.某化学实验小组发现镁和 溶液反应比镁和水反应速率快,通过实验探究速率加快原因和产物成分。
溶液反应比镁和水反应速率快,通过实验探究速率加快原因和产物成分。
(4)速率加快的原因探究
小组同学为研究速率加快可能的原因,分别取0.1g打磨的镁条进行了如下实验
已知:Mg和 反应只能在Mg表面产生微量气泡,
反应只能在Mg表面产生微量气泡, 在中性或碱性条件下不与镁反应。设计实验组2的目的是
在中性或碱性条件下不与镁反应。设计实验组2的目的是_______ ,为控制变量与实验组1一致,应对实验组2进行改进,具体操作为_______ 。
(5)产物成分探究
①将产生的气体点燃有蓝色火焰,通入澄清的石灰水变浑浊,则推测气体成分为 和
和 。
。
②某同学认为逸出的气体会带出少量溶液也能使澄清石灰水变浑浊。于是在密闭容器中利用 传感器测定15分钟三组不同情况下
传感器测定15分钟三组不同情况下 气体浓度变化。
气体浓度变化。
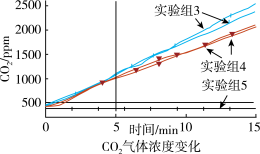
测量时取少量 溶液、少量镁条的原因是
溶液、少量镁条的原因是_______ ;通过图象可以确定镁和 溶液反应生成的气体为
溶液反应生成的气体为_______ 。

时间 | 0.1g | 0.3g | 0.8g |
| 10mL 1.5% | 223s | 67s | 56s |
| 10mL 3.0% | 308s | 109s | 98s |
| 10mL 4.5% | 395s | 149s | 116s |
分析表中数据回答下列问题:
(1)相同浓度的过氧化氢的分解速率随着
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入
(3)该小组的某同学分析上述数据后得出:“当用相同质量的
Ⅱ.某化学实验小组发现镁和
(4)速率加快的原因探究
小组同学为研究速率加快可能的原因,分别取0.1g打磨的镁条进行了如下实验
| 实验组1 | 6mL 1mol/L | 持续产生大量气泡,溶液略显浑浊 |
| 实验组2 | 6mL 1mol/L | 镁表面微量气泡附着 |
已知:Mg和
(5)产物成分探究
①将产生的气体点燃有蓝色火焰,通入澄清的石灰水变浑浊,则推测气体成分为
②某同学认为逸出的气体会带出少量溶液也能使澄清石灰水变浑浊。于是在密闭容器中利用
| 实验组3 | 6mL 1mol/L |
| 实验组4 | 6mL 1mol/L |
| 实验组5 | 空塑料瓶 |

测量时取少量
某化学实验小组发现镁和NaHCO3溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分。
I.探究加快速率的粒子
(1)甲同学推测加快速率的粒子有两种:①Na+能加快化学反应速率。②HCO 能加快化学反应速率。
能加快化学反应速率。
为验证猜想,进行了如下实验:
已知:Mg和H2O反应只能看到镁条表面有极微量气泡附着,生成的Mg(OH)2会附着在镁条表面阻碍反应进行;NO 在中性或碱性条件下不与镁反应。用离子方程式解释对照组中NaHCO3溶液显碱性的原因
在中性或碱性条件下不与镁反应。用离子方程式解释对照组中NaHCO3溶液显碱性的原因______ ;实验组2的目的是_____ ;控制变量与对照组一致,实验组2应在1mol/LNaNO3溶液中______ 。
镁和NaHCO3溶液反应比镁和水反应速率快的原因可能是_____ 。
II.探究气体的成分。
(2)乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声;再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为_____ 。
(3)丙同学认为乙同学的推测不够严谨,逸出的气体会带出少量溶液也能使澄清石灰水变浑浊,于是利用CO2传感器检测放出的气体中是否含有CO2。
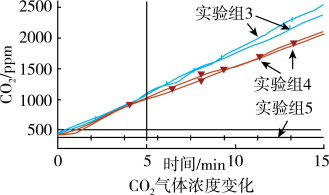
由图象可知,加入Mg条后,CO2释放受到抑制,原因是_____ 。
实验时取少量NaHCO3溶液、少量镁条的原因是_____ 。
I.探究加快速率的粒子
(1)甲同学推测加快速率的粒子有两种:①Na+能加快化学反应速率。②HCO
为验证猜想,进行了如下实验:
| 对照组 | 6mL1mol/LNaHCO3溶液(pH=8.4) | 持续产生大量气泡,溶液略显浑浊 |
| 实验组1 | 6mL1mol/LKHCO3溶液 | 持续产生大量气泡,溶液略显浑浊 |
| 实验组2 | 6mL1mol/LNaNO3溶液 | 镁表面有极微量气泡附着 |
镁和NaHCO3溶液反应比镁和水反应速率快的原因可能是
II.探究气体的成分。
(2)乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声;再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为
(3)丙同学认为乙同学的推测不够严谨,逸出的气体会带出少量溶液也能使澄清石灰水变浑浊,于是利用CO2传感器检测放出的气体中是否含有CO2。
| 实验组3 | 取6mL1mol/LNaHCO3溶液加入250mL塑料瓶,塞紧CO2传感器,采集数据15min,记录液面上方CO2浓度的变化,重复实验2次。 |
| 实验组4 | 取6mL1mol/LNaHCO3溶液、0.1g打磨好的镁条加入250mL塑料瓶,实验操作同上。 |
| 实验组5 | 用上述同样方法采集15min空塑料瓶中CO2浓度的数据。 |

由图象可知,加入Mg条后,CO2释放受到抑制,原因是
实验时取少量NaHCO3溶液、少量镁条的原因是
某化学实验小组发现镁和 溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分。
溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分。
Ⅰ.探究加快速率的粒子
(1)甲同学推测加快速率的粒子有两种:
① 能加快化学反应速率。
能加快化学反应速率。
② 能加快化学反应速率。
能加快化学反应速率。
为验证猜想,进行了如下实验:
已知:Mg和 反应只能看到镁条表面有极微量气泡附着。用离子方程式解释对照组中
反应只能看到镁条表面有极微量气泡附着。用离子方程式解释对照组中 溶液显碱性的原因
溶液显碱性的原因_______ ;实验组1得到的结论是_______ ;为控制变量与对照组一致,实验组2应在1mo/L  溶液中
溶液中_______ 。
Ⅱ.探究气体的成分。
(2)乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声;再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为_______ 。经查阅文献得知, 溶液可以通过自耦电离
溶液可以通过自耦电离 产生
产生 ,该反应的平衡常数为
,该反应的平衡常数为_______ (保留3位有效数字)。(已知: 电离常数
电离常数 ,
, )
)
(3)丙同学认为乙同学的推测不够严谨,逸出的气体会带出少量溶液也能使澄清石灰水变浑浊,于是利用 传感器检测放出的气体中是否含有
传感器检测放出的气体中是否含有 。
。

由图象可知,加入Mg条后, 释放受到抑制,原因是
释放受到抑制,原因是_______ ;实验时取少量 溶液、少量镁条的原因是
溶液、少量镁条的原因是_______ 。
Ⅰ.探究加快速率的粒子
(1)甲同学推测加快速率的粒子有两种:
①
②
为验证猜想,进行了如下实验:
| 对照组 | 1mol/L | 持续产生大量气泡,溶液略显浑浊 |
| 实验组1 | 1mol/L | 持续产生大量气泡,溶液略显浑浊 |
| 实验组2 | 1mol/L | 镁表面有极微量气泡附着 |
Ⅱ.探究气体的成分。
(2)乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声;再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为
(3)丙同学认为乙同学的推测不够严谨,逸出的气体会带出少量溶液也能使澄清石灰水变浑浊,于是利用
| 实验组3 | 取6mL1mol/L |
| 实验组4 | 取6mLlmol/L |
| 实验组5 | 用上述同样方法采集15min空塑料瓶中 |

由图象可知,加入Mg条后,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


